微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某同学设计如图所示实验方案,以分离KCl和BaCl2两种固体混合物。试回答下列问题
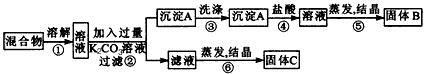
(1)B物质的化学式为_____________。
(2)该方案的明显失误是因某一步设计不当而使分离产物不纯,该步骤是_______ (填序号)如何改进?
_____________________________________
?(3)写出②、④两步中对应的化学方程式:②_____________________, ④_______________________。
参考答案:(l)BaCl2
(2)⑥;先在滤液中加入过量的盐酸,
本题解析:
本题难度:一般
2、选择题 下列实验方法不正确的是( )
A.用过滤的方法除去食盐水中的泥沙
B.用蒸馏的方法将自来水制成蒸馏水
C.用四氯化碳萃取碘水中的碘
D.除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶
参考答案:A.泥沙不溶于水,NaCl溶于水,可用过滤的方法分离,故A正
本题解析:
本题难度:简单
3、填空题 氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质.为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,在将滤液按图所示步骤进行操作.
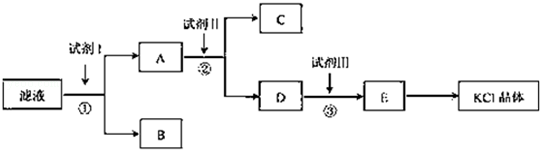
回答下列问题:
(1)起始滤液的pH ? 7(填“大于”、“小于”或“等于”),其原因是 ???????????????? .
(2)试剂I的化学式为 ??????? ,①中发生反应的离子方程式为 ???????? .
(3)试剂Ⅱ的化学式为 ??????? ,②中加入试剂Ⅱ的目的是 ???????? ;
(4)试剂Ⅲ的名称是 ???????? ,③中发生反应的离子方程式为 ???????? ;
(5)某同学称取提纯的产品0.7759g,溶解后定定容在100mL容量瓶中,每次取25.00mL溶液,用0.1000mol?L﹣1的硝酸银标准溶液滴定,三次滴定消耗标准溶液的平均体积为25.62mL,该产品的纯度为 ?????? .(列式并计算结果)
参考答案:(1)大于,K2CO3水解(2)氯化钡;SO42﹣+Ba2+
本题解析:(1)强碱弱酸盐水解导致溶液中氢氧根离子浓度大于氢离子浓度,其水溶液呈碱性.
(2)用氯化钡溶液,能同时除去硫酸根离子和碳酸根离子,根据离子方程式的书写规则书写.
(3)为除去过量的钡离子选用K2CO3作试剂,不仅能除去钡离子同时还生成氯化钾.
(4)最后用盐酸除去过量的碳酸根离子,根据离子方程式的书写规则书写,注意弱电解质和气体写化学式.
(5)先根据硝酸银的物质的量计算25mL氯化钾溶液中含有的氯化钾的物质的量,再计算100mL氯化钾溶液中含有的氯化钾的物质的量,从而计算出其质量,根据质量分数公式计算其质量分数即可.
解:(1)碳酸钾是强碱弱酸盐能水解导致溶液中氢氧根离子浓度大于氢离子浓度,所以溶液呈碱性,PH>7.
故答案为:大于,K2CO3水解.
(2)要除掉杂质离子硫酸根和碳酸根,应加入过量的氯化钡溶液,碳酸根和硫酸根生成不溶于水的钡盐,同时生成氯化钾,离子方程式为:SO42﹣+Ba2+=BaSO4↓,CO32﹣+Ba2+=BaCO3↓.
故答案为:氯化钡;SO42﹣+Ba2+=BaSO4↓,CO32﹣+Ba2+=BaCO3↓.
(3)要除掉多余的钡离子,要加入碳酸钾,碳酸钾和氯化钡反应生成碳酸钡沉淀同时生成氯化钾,离子方程式为CO32﹣+Ba2+=BaCO3↓.
故答案为:K2CO3,除过量BaCl2.
(4)要除掉多余的碳酸根,要滴加适量的盐酸,碳酸根离子和盐酸反应生成二氧化碳和水,离子方程式为CO32﹣+2H+=CO2↑+H2O.
故答案为:盐酸;CO32﹣+2H+=CO2↑+H2O.
(5)设25mL氯化钾溶液中氯化钾的物质的量为nmol.
KCl+AgNO3=AgCl+KNO 31mol 1mol
nmol 0.10 00mol?L﹣1 ×0.02562L
n=0.002562mol
100mL溶液中含有氯化钾的物质的量=0.002562mol×4=0.010248mol
100mL溶液中含有氯化钾的质量=0.010248mol×74.5g/mol=0.764376g
质量分数=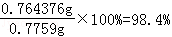 .
.
故答案为:98.4%.
点评:本题考查了除杂试剂的选取和离子方程式的书写等知识点,难度不大,注意解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键.
本题难度:一般
4、选择题 下列各组混合物中,用分液漏斗不能分离的是( )
A.正己烷和水
B.甲苯和水
C.乙酸和乙醇
D.溴苯和水
参考答案:A.正己烷和水互不相溶,能用分液漏斗分离,故A不选;
本题解析:
本题难度:简单
5、选择题 单体为CnH2n的高聚物,其聚合度为m,当ω(g)该物质完全燃烧时,生成CO2的体积在标准状况下为
A.
B.
C.
D.
参考答案:A
本题解析:分析:单体为CnH2n的高聚物,最简式为CH2,根据n=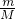 计算最简式的物质的量,根据碳元素守恒计算n(CO2),在根据V=nVm计算生成的CO2的体积.
计算最简式的物质的量,根据碳元素守恒计算n(CO2),在根据V=nVm计算生成的CO2的体积.
解答:单体为CnH2n的高聚物,最简式为CH2,ωg该高聚物最简式的物质的量为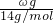 =
= mol,根据碳元素守恒可知,n(CO2)=
mol,根据碳元素守恒可知,n(CO2)= mol,故标准状况下生成二氧化碳的体积为
mol,故标准状况下生成二氧化碳的体积为 mol×22.4L/mol=
mol×22.4L/mol= L,故选A.
L,故选A.
点评:考查常用化学计量的有关计算,难度中等,注意根据最简式的计算.
本题难度:困难