微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列性质对氧族元素(O、S、Se、Te)和卤族元素(F、Cl、Br、I)均无例外的是(???)
A.氢化物水溶液均呈酸性
B.都存在含氧酸,都能表现+6价或+7价
C.除氧外均可在一定条件下得到氧化物
D.其单质均可与钠作用
参考答案:D
本题解析:O的氢化物H2O为中性;F、O不存在含氧酸;O、F不存在氧化物。
本题难度:简单
2、选择题 常温下能用铁罐或铝罐贮存的是
A.浓H2SO4
B.浓HCl
C.稀H2SO4
D.稀HCl
参考答案:A
本题解析:由于常温下,浓硫酸可使铁、铝表面生成一薄层致密的氧化物薄膜,阻止内部金属继续跟硫酸反应,即发生了“钝化”现象,所以可用铁、铝制容器盛放冷的浓硫酸。
本题难度:简单
3、实验题 黄铁矿是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对某黄铁矿石(主要 成分为FeS2)进行硫元素含量测定的实验探究及工业生产硫酸的探究。
I .将m1,g该黄铁矿样品(杂质中不含硫和铁)放入如下图所示装置(夹持和加热装置 省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2 + 11O2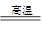 ?2Fe2O3 + 8SO2
?2Fe2O3 + 8SO2
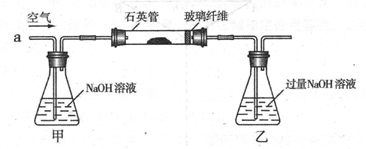
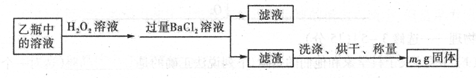
II反应结束后,将乙瓶中的溶液进行如下处理
(1)I中,乙瓶内发生反应的离子方程式有____________、__________。
(2)II中,所加H2O2溶液需足量的理由是____________________________
(3)该黄铁矿石中硫元素的质量分数为____________________________
(4)简述在催化反应室中设置热交换器的目的:______________。
(5)工业生产中常用氨——硫酸法进行尾气脱硫,以达到消除污染、废物利用的目的,用 两个化学方程式表示其反应原理_______________、______________
参考答案:(15分)
(1)SO2 + 2OH-=SO32- +
本题解析:
试题分析:(1)乙中二氧化硫和氢氧化钠反应生成亚硫酸钠,离子方程式为 SO2+2OH-=SO32-+H2O,亚硫酸钠和氧气反应生成硫酸钠,离子方程式为2SO32-+O2=2SO42-,故答案为: SO2+2OH-=SO32-+H2O;2SO32-+O2=2SO42-;(2)为使亚硫酸根离子完全转化为硫酸根离子,加入的双氧水要足量,故答案为:使SO32-完全氧化为SO42-;(3)最终所得沉淀是硫酸钡,根据硫原子守恒得硫的质量,设硫的质量为x,
S-----BaSO4
32g?? 233
本题难度:一般
4、填空题 工业上常产生大量的废气、废水、废渣、废热,如果处理不好,随意排放,会造成污染,而如果科学回收,可变废为宝。
(1)工业制硫酸的尾气中含有的少量SO2,可先用氨水吸收,再用稀硫酸处理。
①该反应的化学方程式为_________;
②这样处理的优点是____________________。
(2)硫酸厂产生的大量烧渣(硫铁矿煅烧后的灰渣)的用途是________(写一种即可);写出电解精炼铜阳极泥的一种用途________。
(3)一座大型硫酸厂同时又是一座能源工厂,硫酸厂生产过程中的余热若能充分回收利用,不仅不需要外界供应能源,而且还可以向外界输出大量的热能。硫酸厂产生余热的主要设备名称是________。
(4)干熄焦技术是将炼焦炉推出的约1 000℃的赤热焦炭,在熄焦室中被其逆流的冷惰性气体(主要成分是氮气,温度在170~190℃)熄灭,被加热到700~800℃的惰性气体经除尘后进入余热锅炉,产生的过热蒸气送往汽轮发电机发电。干熄1 t焦炭可产生500 kg过热蒸气,可折合成46 kg标准煤。举出两例采用逆流原理的化工设备或化学仪器________、________。
参考答案:(1)①SO2+NH3·H2O=NH4HSO3、 2NH4H
本题解析:(2)硫酸厂产生的大量烧渣中含有丰富的铁元素(以Fe2O3形式存在),可用于炼铁。(3)盘点工业接触法制硫酸的化学反应中,矿石的燃烧和二氧化硫的接触氧化属于放热反应,这两个反应分别在沸腾炉和接触室中进行。
本题难度:一般
5、选择题 物质用途的描述中,错误的是
A.双氧水、臭氧都可用于杀菌消毒
B.二氧化硫可用来漂白纸浆、毛、丝等
C.浓硫酸可用于干燥NH3、H2、O2等气体
D.红磷用于制安全火柴
参考答案:C
本题解析:略
本题难度:简单