微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
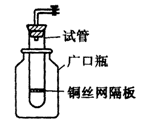
1、实验题 (11分)(1)某学生用实验室常见的酸、碱、盐和金属为反应物,并利用一个底部有小孔的试管和一个广口瓶组装成如图所示的替代简易气体发生器的即开即停装置,该装置中装有铜丝网隔板,利用该装置可制取哪些气体_________________(答2种即可);
若将铜丝网隔板改为铁丝网隔板,则该装置可用于制取何种气体________,写出反应的离子方程式_______________。
(2)①写出CO2和Na2O2反应的化学方程式______________________。
②某学生判断SO2和Na2O2反应能生成硫酸钠,你认为他的判断是否合理_______,(填“是或否”)简要说明理由:______________________。
③该同学无法断定SO2和Na2O2反应中是否有氧气生成,拟使用下列装置进行实验。
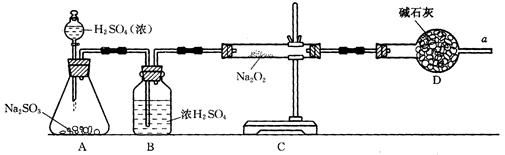
装置中B的作用是_______________,D的作用是_______________。
④为确认SO2和Na2O2反应产物,该同学设计了以下实验步骤,你认为应进行的操作按顺序排列是(填序号)________。
A.用带火星的细木条靠近干燥管口a,观察细木条是否着火燃烧.
B.将C装置中反应后的固体物质溶于适量水配成溶液.
C.在配成的溶液中加入用硝酸酸化的硝酸钡溶液,观察是否有沉淀生成.
D.在配成的溶液中先加入盐酸,再加入氯化钡溶液,观察是否有气泡或沉淀生成
参考答案:(11分)(除方程式,每空1分)
(1)H2 CO2
本题解析:(1)固液不加热可制取的气体共三种:H2、CO2?、H2S。而制后两种气体进均需用到酸,所以改用铁丝网时就不能制取了,只能换作碱性溶液和铝来制取的氢气了。
(2)④检验是否有氧气的生成一般用带火星的木条。检验SO42—的存在一般是先加入盐酸,再加入氯化钡溶液,观察是否有沉淀生成
本题难度:一般
2、选择题 2005年12月某地上发生一起车祸,一辆载运浓硫酸的罐车,翻入池塘,大量浓硫酸泄露,有关部门组织抢险,通过附近的建筑工地对池塘的硫酸进行处理,很快控制污染的曼延,从化学知识和经济节约考虑,对池塘进行处理的物质和罐车的材料可能是(??)
A.烧碱和合成塑料
B.生石灰和铝(或铁)
C.生石灰和铜
D.纯碱和铜
参考答案:B
本题解析:略
本题难度:简单
3、选择题 在标准状况下,将a molH2S 和 b mol O2混合充分燃烧后,两反应物都没有剩余,得到三种产物(H20 S? S02),则下列说法正确的是???(?????)?
A.产生的S0 2为(b -0.5a)mol????????B.反应后生成的水的质量为18a克
C.3a﹥2b﹥ a??????????????????????D反应后氧化产物的质量为(16a-32b )克
参考答案:D
本题解析:略
本题难度:简单
4、选择题 设计实验证明亚硫酸既有氧化性又有还原性,必选试剂是 (??? )
A.盐酸、浓硫酸、氯化钡溶液
B.溴水、硫化钠溶液、稀硫酸
C.硝酸、硫化氢、氢氧化钠溶液
D.氧气、氯化钡溶液、水
参考答案:B
本题解析:略
本题难度:简单
5、实验题 (10分)下表是某城市某日的空气质量报告:
污染指数
| 首要污染物
| 空气质量级别
| 空气质量状况
|
55
| SO2
| II
| 良
该市某校研究性学习小组对表中首要污染物SO2导致酸雨的成因进行了如下探究:
[探究实验一]用下图所示装置进行实验。
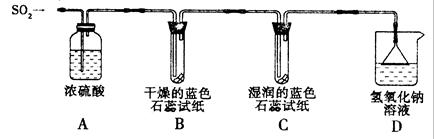
① A装置的作用是?????(填“干燥”或“氧化”)SO2气体。
②实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试纸变???色,说明SO2与水反应生成一种酸。
③ D装置的作用是?????????,D中发生反应的化学方程式是?????????????。
[探究实验二]往盛有水的烧杯中通入SO2气体,测得所得溶液的pH?????7(填“>”“=”或“<”),然后每隔1 h测定其pH,发现pH逐渐?????(填“变大”或“变小”),直至恒定。说明烧杯中的溶液被空气中的氧气氧化最终生成H2SO4。
[查阅资料]SO2形成酸雨的另一途径为:SO2与空气中的O2在飘尘的作用下反应生成SO3,SO3溶于降水生成H2SO4。则在此过程中的飘尘是作为?????(填“催化剂”或“氧化剂”)。
[探究结论]SO2与空气中的氧气、水反应生成硫酸而形成酸雨。该市可能易出现酸雨。
[知识拓展]
(1)汽车排放的尾气,硝酸、化肥等工业生产排出的废气中都含有氮的氧化物,氮的氧化物溶于水最终转化为?????,是造成酸雨的另一主要原因。
(2)该市某工厂的燃料煤中硫的质量分数为0.16%,该工厂每天燃烧这种煤100吨。如果煤中的硫全部转化为SO2,那么这些SO2在标准状况下的体积约为?????m3。
参考答案:(共10分,每空1分,最后一空2分)
[探究实验一]干
本题解析:[探究实验一]考查了二氧化硫的干燥、漂白性、尾气吸收。
[探究实验二]二氧化硫为酸性氧化物,可表现还原性
SO2+H2O=H2SO3????? 2H2SO3 +O2=2H2SO4
[知识拓展](2)????? S???? ??SO2 ??SO2
_???????????? 32×10—6 t?????
本题难度:一般
|