微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将含有0.4molNaCl和0.5mol?Cu(N03)2的水溶液1L,用惰性电极电解一段时间后,在一个电极上得到0.3mol?Cu,则在另一个电极上析出的气体(标准状况下)的体积是( )
A.4.48L
B.5.6L
C.6.72L
D.11.2L
参考答案:将含有0.4mol?NaCl和0.5mol?Cu(N03)2
本题解析:
本题难度:简单
2、选择题 21世纪是钛的世纪。在800℃~1 000℃时电解TiO2可制得钛,装置如图所示。下列叙述正确的是( )

A.a为电源的正极
B.石墨电极上发生还原反应
C.阴极发生的反应为:TiO2+4e-=Ti+2O2-
D.每生成0.1 mol钛,转移电子0.2 mol
参考答案:C
本题解析:由O2-移动方向可知b为电源正极,A项错误;b为电源正极,石墨电极上发生氧化反应,B项错误;D项每生成0.1 mol钛,转移电子0.4 mol,错误。
本题难度:一般
3、选择题 如图所示,a,b,c,d均为石墨电极,通电进行电解,下列说法正确的是(??)
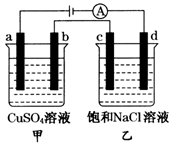
A.乙池中d的电极反应为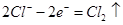
B.a,c两极产生气体的物质的量相等
C.甲、乙两池中溶液pH均保持不变
D.乙池中发生的反应为
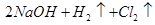
参考答案:D
本题解析:考查电解原理
甲池:2CuSO4+2H2O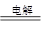 2Cu+O2↑+2H2SO4
2Cu+O2↑+2H2SO4
a极是阳极: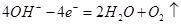 、b极为阴极:
、b极为阴极:
本题难度:一般
4、简答题 (14 分)铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛。
(1)真空碳热还原-氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下:
Al2O3(s)+AlC13(g)+3C(s) ="3AlCl(g)+3CO(g)" △H="a" kJ·mol-1
3AlCl(g)=2Al(l)+AlC13(g) △H="b" kJ·mol-1
①反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H= kJ·mol-1(用含a、b 的代数式表示)。
②Al4C3是反应过程中的中间产物。Al4C3与盐酸反应(产物之一是含氢量最高的烃) 的化学方程式为 。
(2)镁铝合金(Mg17Al12 )是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、Al 单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为Mg17Al122+17H2=17MgH2+12Al。得到的混合物Y(17MgH2 +12Al)在一定条件下可释放出氢气。
①熔炼制备镁铝合金(Mg17Al12)时通入氩气的目的是 。
②在6. 0 mol·L-1 HCl 溶液中,混合物Y 能完全释放出H2。1 mol Mg17 Al12完全吸氢后得到的混合物Y 与上述盐酸完全反应,释放出H2的物质的量为 。
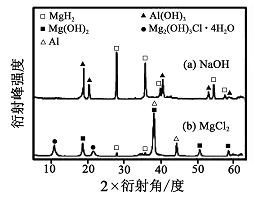
③在0. 5 mol·L-1 NaOH 和1. 0 mol·L-1 MgCl2溶液中, 图8
混合物Y 均只能部分放出氢气,反应后残留固体物质的X-射线衍射谱图如图所示(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。在上述NaOH 溶液中,混合物Y 中产生氢气的主要物质是 (填化学式)。
(3)铝电池性能优越,Al-AgO 电池可用作水下动力电源,其原理如图所示。该电池反应的化学方程式为 。

参考答案:(1)①a+b
本题解析:(1)根据盖斯定律,将题中所给两方程式相加得所求反应,对应的△H=(a+b)kJ·mol-1。含氢量最高的烃为CH4,根据碳原子守恒,3个碳需要结合12个H原子形成3个CH4。再由铝原子守恒,4个铝需要结合12个Cl形成4个AlCl3,所以Al4C3与HCl之间为1:12参加反应。(2)①镁、铝都是活泼的金属单质,容易被空气中的氧气氧化,通入氩气作保护气,以防止二者被氧化。②1mol Mg17Al12完全吸氢 17mol,在盐酸中会全部释放出来。镁铝合金中的镁和铝都能与盐酸反应生成H2,物质的量分别为17mol、18mol,则生成氢气一共52mol。③镁与NaOH不反应,再根据衍射谱图可知,在NaOH溶液中产生氢气的主要物质是铝。(3)铝做负极,失电子被氧化,在碱性溶液中生成NaAlO2。氧化银做正极,得电子被还原为Ag,电解质溶液为NaOH溶液,由此可写出总反应。
【考点定位】盖斯定律,铝及其化合物的性质以及电化学反应方程式
本题难度:一般
5、选择题 惰性电极电解饱和食盐水,当溶液中有1mol NaOH生成时,则下列说法不正确的是
A.阴极析出氢气
B.标准状况下,阴极产生的气体为11.2L
C.阳极的电极反应式:2H2O + 2e- = 2OH-+ H2↑
D.电路中有1mol电子通过
参考答案:C
本题解析:略
本题难度:简单