微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 向橙色的溴水中通入SO2气体,观察到的现象是____________。有关的离子方程式为___________________________
参考答案: 本题解析:略
本题解析:略
本题难度:一般
2、选择题 0.44 g铜镁合金完全溶解于100 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体336 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到0.78 g沉淀。下列说法正确的是
A.该合金中铜与镁的质量量之比是2∶1
B.该浓硝酸中HNO3的物质的量浓度是7.0 mol/L
C.NO2和N2O4的混合气体中,NO2的体积分数是80%
D.得到0.78 g沉淀时,加入NaOH溶液的体积是1380mL
参考答案:D
本题解析:
试题解析:A、金属离子全部沉淀时,得到0.78g沉淀为氢氧化铜、氢氧化镁,故沉淀中氢氧根的质量为0.78g-0.44g=0.34g,氢氧根的物质的量为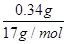 =0.02mol,根据电荷守恒可知,金属提供的电子物质的量等于氢氧根的物质的量,令铜、镁合金中Cu、Mg的物质的量分别为xmol、ymol,则:
=0.02mol,根据电荷守恒可知,金属提供的电子物质的量等于氢氧根的物质的量,令铜、镁合金中Cu、Mg的物质的量分别为xmol、ymol,则: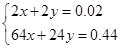 ,解得x=0.005,y=0.005,故合金中铜与镁的物质的量之比是0.005mol:0.005mol=1:1,故A错误;B、该浓硝酸密度为1.40g/mL、质量分数为63%,故该浓硝酸的物质的量浓度为
,解得x=0.005,y=0.005,故合金中铜与镁的物质的量之比是0.005mol:0.005mol=1:1,故A错误;B、该浓硝酸密度为1.40g/mL、质量分数为63%,故该浓硝酸的物质的量浓度为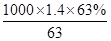 mol/L=14mol/L,故B错误;C、NO2和N2O4混合气体的物质的量为
mol/L=14mol/L,故B错误;C、NO2和N2O4混合气体的物质的量为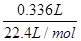 =0.015mol,令二氧化氮的物质的量为amol,则四氧化二氮的物质的量为(0.015-a)mol,根据电子转移守恒可知,a×1+(0.015-a)×2×1=0.02,解得a=0.01,故NO2的体积分数是
=0.015mol,令二氧化氮的物质的量为amol,则四氧化二氮的物质的量为(0.015-a)mol,根据电子转移守恒可知,a×1+(0.015-a)×2×1=0.02,解得a=0.01,故NO2的体积分数是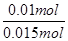 ×100%=66.7%,故C错误;D、根据钠离子守恒可知,氢氧化钠的物质的量等于反应后溶液中硝酸钠的物质的量,根据氮元素守恒可知,硝酸钠的物质的量为0.1L×14mol/L-0.01mol-(0.015-0.01)×2=1.38mol,故需要氢氧化钠溶液的体积为
×100%=66.7%,故C错误;D、根据钠离子守恒可知,氢氧化钠的物质的量等于反应后溶液中硝酸钠的物质的量,根据氮元素守恒可知,硝酸钠的物质的量为0.1L×14mol/L-0.01mol-(0.015-0.01)×2=1.38mol,故需要氢氧化钠溶液的体积为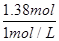 =1.38L=1380mL,故D正确。
=1.38L=1380mL,故D正确。
考点:化学计算
本题难度:一般
3、选择题 下列计算结果正确是( )
A.标准状况下,用一充满氨气的干燥烧瓶做喷泉实验,当水充满整个烧瓶后(假设溶液不外溢),烧瓶内氨水的物质的量的浓度为(
1
22.4
)mol/L
B.标准状况下,将64g?铜片投入到100ml?18?mol/L的浓硫酸中加热会产生22.4?L的SO2气体
C.向1mol的碳酸钾固体中缓缓滴加少量的稀盐酸会产生1mol的CO2气体
D.向含有1mol?Ba(OH)2溶液中通入1molCO2气体就会产生1mol?Ba(HCO3)2的白色沉淀
参考答案:A、令烧瓶的容积为VL,则氨气的体积为VL,氨气的物质的量为
本题解析:
本题难度:一般
4、选择题 下列叙述不正确的是 (????)
A.工业上可用碳在高温下还原二氧化硅制取硅
B.工业上可用氯气和石灰乳为原料制造漂白粉
C.镁条能在二氧化碳气体中燃烧,生成氧化镁
D.根据分散质粒子的直径大小,分散系可分为溶液、浊液和胶体,浊液的分散质粒子大小介于溶液与胶体之间
参考答案:D
本题解析:D错误,粒子直径大小顺序为溶液〉胶体〉浊液。所以应选D
本题难度:一般
5、填空题 按照要求回答下列问题写出下列变化的化学方程式:
(1)实验室制乙烯(注明反应条件)______.
(2)乙烯→氯乙烷______.
已知:甲酸和乙酸相类似,具有下列性质:①挥发性??②酸性??③比碳酸的酸性强??④还原性??⑤能发生酯化反应.
下列各实验中,分别填出表现甲酸相应性质的编号:
(3)在碳酸钠溶液中加入甲酸有气体放出,说明甲酸具有______
(4)在甲酸钠晶体中加入浓磷酸,加热后放出能使湿润蓝色石蕊试纸变红的气体,说明甲酸具有______
(5)与乙醇、浓硫酸混和后共热,能闻到一种香味,说明甲酸具有
(6)在甲酸溶液中加入氢氧化铜,能看到溶液变蓝色,说明甲酸具有______
(7)在新制氢氧化铜中加入甲酸溶液,加热看到有红色沉淀生成,说明甲酸具有______.
参考答案:(1)实验室中利用乙醇在浓硫酸的作用下加热发生消去反应来制乙
本题解析:
本题难度:简单
|