微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)氮的氢化物NH3、N2H4等在工农业生产、航空航天等领域有广泛应用。
(1)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨的燃烧实验涉及下列两个相关的反应:
①4NH3(g)+5O2(g)=4NO(g)+6H2O(l) △H1
②4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H2
则反应 4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H= 。(请用含有△H1、△H2的式子表示)
(2)合成氨实验中,在体积为3 L的恒容密闭容器中,投入4 mol N2和9 mol H2在一定条件下合成氨,平衡时仅改变温度测得的数据如下表所示:
温度(K)
| 平衡时NH3的物质的量(mol)
|
T1
| 2.4
|
T2
| 2.0
已知:破坏1 mol N2(g)和3 mol H2(g)中的化学键消耗的总能量小于破坏2 mol NH3(g)中的化学键消耗的能量。
①则T1 T2(填“>”、“<”或“=”)
②在T2 K下,经过10min达到化学平衡状态,则0~10min内H2的平均速率v(H2)= ,平衡时N2的转化率α(N2)= 。
③下列图像分别代表焓变(△H)、混合气体平均相对分子质量(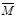 )、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是 。 )、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是 。
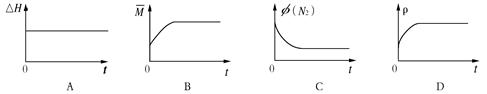
(3)某N2H4(肼或联氨)燃料电池(产生稳定、无污染的物质)原理如图1所示。
①M区发生的电极反应式为 。
②用上述电池做电源,用图2装置电解饱和氯化钾溶液(电极均为惰性电极),设饱和氯化钾溶液体积为500mL,当溶液的pH值变为13时(在常温下测定),若该燃料电池的能量利用率为80%,则需消耗N2H4的质量为 g(假设溶液电解前后体积不变)。
参考答案:(14分)
(1)(3△H1+2△H2)/5(2分)<
本题解析:
试题分析:(1)根据盖斯定律,将NO消去,可得4NH3(g)+3O2(g)=2N2(g)+6H2O(l)
△H=(3△H1+2△H2)/5;
(2)①T2到T1变化时,氨气的物质的量增大,说明改变温度,平衡正向移动,而正向是放热反应,所以温度变化是降低温度,则T1<T2;
②在T2 K下,经过10min达到化学平衡状态,氨气的物质的量是2mol,根据反应的化学方程式,则消耗氢气的物质的量是3mol,则0~10min内H2的平均速率v(H2)=3mol/3L/10min=0.1mol·L-1·min-1;消耗氮气的物质的量是1mol,所以氮气的转化率是1mol/4mol×100%=25%;
③A、反应的化学方程式固定,则反应热不变,所以不能判断为平衡状态,错误;B、该反应是气体的物质的量减小的可逆反应,所以气体的平均摩尔质量增大,达到平衡时,气体的平均摩尔质量不变,正确;C、随反应的进行,氮气的体积分数不断减小,达到平衡时,保持不变,正确;D、容器的体积不变,则气体的密度一直不变,所以不能判断为平衡状态,错误,答案选BC;
(3)①根据装置图中氢离子的移动方向判断M区为负极区,则N2H4在负极发生氧化反应,失去电子生成氮气和氢离子,电极反应式是N2H4-4e?==N2↑+4H+;
②用该电池电解氯化钠溶液,化学方程式是2NaCl+2H2O 2NaOH+H2↑+Cl2↑, 500mL的溶液的pH=13,则氢氧根离子的浓度是0.1mol/L,氢氧根离子的物质的量是0.05mol,根据得失电子守恒,所以电池中转移电子的物质的量是0.05mol,该燃料电池的能量利用率为80%,所以需要N2H4的质量为0.05mol/4×32g/mol/80%=0.5g。 2NaOH+H2↑+Cl2↑, 500mL的溶液的pH=13,则氢氧根离子的浓度是0.1mol/L,氢氧根离子的物质的量是0.05mol,根据得失电子守恒,所以电池中转移电子的物质的量是0.05mol,该燃料电池的能量利用率为80%,所以需要N2H4的质量为0.05mol/4×32g/mol/80%=0.5g。
考点:考查盖斯定律的应用,反应速率的计算,平衡状态的判断,电化学反应原理的应用
本题难度:困难
2、选择题 下列电池工作时,O2在正极放电的是

| 
| 
| 
| A.锌锰电池
| B.氢燃料电池
| C.铅蓄电池
| D.镍镉电池
参考答案:B
本题解析:
试题分析:A、锌锰电池的正极放电的是MnO2,错误;B、氢燃料电池中,氧气在正极放电生成氢氧根离子或水,正确;C、铅蓄电池的正极放电的是PbO2,得电子生成硫酸铅,错误;D、镍镉电池在正极放电的是NiOOH,错误,答案选B。
考点:考查原电池的反应原理的判断
本题难度:简单
3、选择题 Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为:2Li++FeS+2e-═Li2S+Fe??有关该电池的下列叙述中正确的是( )
A.该电池的电池反应式为:2Li+FeS═Li2S+Fe
B.Li-Al在电池中作为负极材料,该材料中Li的化合价为+1价
C.负极的电极反应式为:Al-3e-═Al3+
D.Li-Al/FeS电池是一种一次性电池
参考答案:A、根据正极反应2Li++FeS+2e-=Li2S+Fe与负
本题解析:
本题难度:一般
4、选择题 氢氧燃料电池已用于航天飞机,以30%KOH溶液为电解质溶液。电极反应如下:
2H2 +4OH--4e- = 4H2O,O2+2H2O+4e- = 4OH- 。据此作出判断,下列说法中不正确的是 [???? ]
A.O2在正极发生还原反应
B.电池总反应为2H2 + O2 = 2H2O
C.反应时负极附近pH增大
D.氢氧燃料电池属于环境友好电池
参考答案:C
本题解析:
本题难度:一般
5、选择题 某新型 “纸”电池以碳纳米管和金属锂作为两极,造纸用的纤维素在一种离子液体X中溶解并做成隔离膜,电池工作时的总反应为:xLi+C(碳纳米管)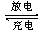 LixC,下列有关说法正确的是 LixC,下列有关说法正确的是
A.放电时Li+由正极向负极移动
B.充电时的阳极反应为:LixC-xe-=C+xLi+
C.X可能为羧酸、醇等含活泼氢的有机物
D.锂离子电池的比能量(单位质量释放的能量)低
参考答案:B
本题解析:略
本题难度:一般
|
|