微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 人体血液的正常pH约为7.35~7. 45,若在外界因素作用下突然发生改变就会引起“酸中毒” 或“碱中毒”,甚至有生命危险。由于人体体液的缓冲系统中存在如下平衡:
H++HCO3-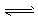 H2CO3
H2CO3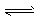 CO2+H2O,H++PO43-
CO2+H2O,H++PO43-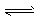 HPO42-?, H++HPO42-
HPO42-?, H++HPO42-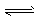 H2PO4- 故能维持血液pH的相对稳定,以保证正常生理活动。下列说法中不合理的是 [???? ]
H2PO4- 故能维持血液pH的相对稳定,以保证正常生理活动。下列说法中不合理的是 [???? ]
A.当强酸性物质进入人体的体液后,上述缓冲系统的平衡向右移,从而维持pH稳定
B.当强碱性物质进入人体的体液后,上述缓冲系统的平衡向左移,从而维持pH稳定
C.某病人在静脉滴注了大量生理盐水后,血液被稀释,会导致c(H+)显著减少,pH显著增大,可能会引起碱中毒
D.在人体进行呼吸活动时,如CO2进入血液,会使平衡向左移动,c(H+)增大,pH略减小
参考答案:C
本题解析:
本题难度:一般
2、填空题 直接排放含SO2,的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2在钠碱循环法中,用Na2SO3溶液作为吸收液,吸收液吸收SO2的过程中,pH随n(SO32-): n(HSO3-)变化关系如下表:
n(SO32-):n(HSO3-)
| 91:9
| 1:1
| 1:91
|
pH
| 8.2
| 7.2
| 6.2
(1)上表判断NaHSO3溶液显___________性,用化学平衡原理解释____________________________________________________________________________
(2)当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):
a. c(Na+ )=" 2c(" SO32-) + c( HSO3-)
b. c(Na+ )> c( HSO3-)>c( SO32-) >c(H+)>c(OH-)
c. c(Na+ )+ c(H+)="c(" HSO3-)+c( SO32-) +c(OH-)
当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下:
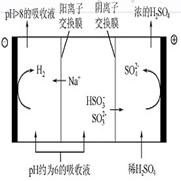
(3)HSO3-在阳极放电的电极反应式是_________________________________________
(4)当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理:
________________________________________________________________________
参考答案:(1)酸; 本题解析: 本题解析:
试题分析:(1)由表给数据n(SO32—):n(HSO3—)=1:1时,溶液PH=7.2,可知溶液显酸性,这说明HSO3—的水解程度小于HSO3—的电离程度,所以溶液显酸性。
(2)收液显中性必然是亚硫酸钠和亚硫酸钠的混合液,溶液中电荷守恒的关系为:c(Na+)+ c(H+)= 2c(SO32—)+ c(HSO3—)+ c(OH—),由此可判断a正确,b、c不正确。
(3)阳极发生氧化反应,所以HSO3—在阳极失去电子生成SO42—和H+。
(4)阴极H+放电破坏水的电离平衡,溶
本题难度:困难
3、选择题 把0.05摩NaOH固体分别加入下列100毫升液体中。溶液的导电性基本不变的是
A.自来水
B.0.5摩/升的盐酸
C.0.5摩/升的醋酸
D.0.5摩/升的氨水
参考答案:B
本题解析:溶液的导电性基本不变,指最终溶液中可自由移动离子的浓度不变。A中加入NaOH,溶液的导电性会显著增强。B中NaOH+HCl=NaCl+H2O等摩的酸、碱反应,生成Na+、Cl-,浓度和反应前H+、Cl-浓度相同,所以导电性不变,C中由于生成强电解质CH3COONa,使溶液的导电性增强。D中加入NaOH,导电性增强。
本题难度:一般
4、选择题 下表是相同温度下三种酸的一些数据,下列判断正确的是
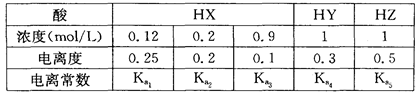
A.在相同温度下,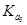 > > > >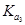
B.室温时,若在NaZ溶液中加水,则 / /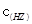 · · 的比值变小,若加少量盐酸,则比值变大 的比值变小,若加少量盐酸,则比值变大
C.等物质的量浓度的NaX、NaY和NaZ的混合溶液,则 < <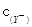 < <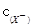
D.在相同温度,从HX的数据可以说明:弱电解质溶液浓度越低,电离度越大,且 > >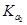 > >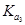 =0.01 =0.01
参考答案:A
本题解析:
试题分析:电离度是弱电解质达到电离平衡时已经电离的电解质分子浓度占电解质分子总浓度的百分比。它不仅以温度有关,还与电解质的浓度有关。电离平衡常数是弱电解质达到电离平衡时电离产生的各种离子浓度的乘积与未电离的电解质分子的浓度的比。它只与温度有关,而与浓度无关。A.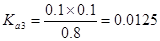 ; ; 本题难度:简单 本题难度:简单
5、填空题 一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如下图所示,
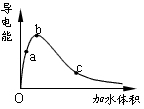
(1)O点导电能力为0的理由是___________________________________
(2)a、b、c三点溶液的c(H+)由小到大的顺序是___________________________________
(3)a、b、c三点醋酸的电离程度最大的是__________________________________
(4)要使c点c(CH3COO- )增大,c(H+)减少,可采取的措施是(至少写出三种方法)①_____________ ②___________________③__________________________
参考答案: (1)在O点醋酸未电离,无自由离子存在
(2)
本题解析:
本题难度:一般
|