微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 为了证明一水合氨(NH3·H2O)是弱电解质,甲、乙、丙三人分别选用下列试剂进行实验:
0.010 mol·L-1氨水、0.1 mol·L-1 NH4Cl溶液、NH4Cl晶体、酚酞试液、pH试纸、蒸馏水。
(1)甲用pH试纸测出0.010 mol·L-1氨水的pH为10,则认定一水合氨是弱电解质,你认为这一方法是否正确???????(填“正确”或“不正确”),并说明理由????????。
(2)乙取出10 mL 0.010 mol·L-1氨水,用pH试纸测其pH=a,然后用蒸馏水稀释至1 000 mL,再用pH试纸测其pH=b,若要确认NH3·H2O是弱电解质,则a、b应满足什么关系????????。
(3)丙取出10 mL 0.010 mol·L-1氨水,滴入2滴酚酞试液,显粉红色,再加入少量NH4Cl晶体,溶液颜色变???????(填“深”或“浅”)。你认为这一方法能否证明NH3·H2O是弱电解质???????(填“能”或“否”),并说明原因?????????????????????????。
(4)请你根据所提供的试剂,再提出一个合理又简便的方案证明NH3·H2O是弱电解质:???????????????????????????。
参考答案:(1)正确 若是强电解质,则0.010 mol·L-1氨水中
本题解析:(1)若NH3·H2O是强电解质,则0.010 mol·L-1氨水中c(OH-)应为0.010 mol·L-1,pH=12。用pH试纸测出0.010 mol·L-1氨水的pH为10,说明NH3·H2O没有完全电离,应为弱电解质。
(2)若NH3·H2O是强电解质,用蒸馏水稀释至1 000 mL,其pH=a-2。因为NH3·H2O是弱电解质,不能完全电离,a、b应满足a-2<b<a。
(3)向0.010 mol·L-1氨水中加入少量NH4Cl晶体,有两种可能:一是氯化铵在水溶液中电离出的NH4+
本题难度:一般
2、简答题 (22分)研究碳及其化合物的性质和用途是中学化学的任务之一。
I.某兴趣小组在实验室中制备碳酸钠溶液。方案如下:步骤一,取25 mL一定浓度的NaOH溶液,通人CO2气体至过量;步骤二,加热煮沸步骤一所得溶液;步骤三,另取25 mL相同浓度的NaOH溶液与步骤二所得溶液混合,即得碳酸钠溶液。
(1)完成步骤一可选的化学试剂有:稀盐酸、NaOH溶液、大理石、饱和碳酸钠溶液、稀硫酸、饱和碳酸氢钠溶液等,需要的装置如下所示。
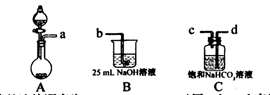
①各装置正确的连接顺序为 (用a、b、c、d表示)。
②检查整套装置气密性的方法是 。
③装置A中常用药品为 ;装置C中化学药品的作用是 。
(2)写出步骤三中发生反应的离子方程式 。
(3)有同学提出“步骤二”没有必要,请你简述自己的看法 。
Ⅱ.实验室用纯碱和盐酸处理某种蛇纹石(已知蛇纹石中含有MgO、SiO2.CaO、Fe2O3、Al2O3等氧化物)模拟制备氧化镁的流程如下:
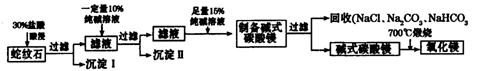
(1)过滤需要的玻璃仪器有 。
(2)沉淀Ⅱ的成分为 ,请用离子方程式表示生成沉淀的过程 (写出一个即可)。
(3)纯碱溶液中所有离子浓度的大小关系为 。
(4)已知l0%的纯碱溶液密度为1.06g/cm3,则其物质的量浓度为____ ,
参考答案:I.(1)①a 本题解析:
本题解析:
试题分析:I.根据题意知,该小组制备碳酸钠溶液的原理为:CO2(过量)+NaOH====NaHCO3,NaOH+NaHCO3====Na2CO3+H2O。(1)分析题给装置知,A为二氧化碳的发生装置,B中发生二氧化碳与氢氧化钠溶液的反应,C装置除去二氧化碳中的氯化氢;①为制得纯净的碳酸氢钠溶液,要先除去二氧化碳中的氯化氢,各装置正确的连接顺序为a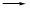 d
d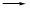 c
c b。②检查整套装置气密性的方法是关闭分液漏斗活塞,向烧杯中加水至没过导管口,微热烧瓶,导管口有气泡冒出,停止加热,导管内形成一段水柱,说明装置气密性良好。③实验室制备二氧化碳的原理为碳酸钙和稀盐酸反应,装置A中常用药品为稀盐酸和大理石;装置C中化学药品的作用是除去二氧化碳中的氯化氢。 (2)步骤三中发生反应的离子方程式为OH-+HCO3—====CO32—+H2O。 (3)步骤二的目的为除去溶解的过量的二氧化碳,否则将使碳酸钠不纯。
b。②检查整套装置气密性的方法是关闭分液漏斗活塞,向烧杯中加水至没过导管口,微热烧瓶,导管口有气泡冒出,停止加热,导管内形成一段水柱,说明装置气密性良好。③实验室制备二氧化碳的原理为碳酸钙和稀盐酸反应,装置A中常用药品为稀盐酸和大理石;装置C中化学药品的作用是除去二氧化碳中的氯化氢。 (2)步骤三中发生反应的离子方程式为OH-+HCO3—====CO32—+H2O。 (3)步骤二的目的为除去溶解的过量的二氧化碳,否则将使碳酸钠不纯。
Ⅱ.根据题给流程分析,蛇纹石用30%盐酸酸浸,MgO、CaO、Fe2O3、Al2O3和盐酸反应溶解,反应方程式分别为:MgO+2HCl=MgCl2+H2O,CaO+2HCl=CaCl2+H2O,Fe2O3+6HCl=2FeCl3+3H2O,Al2O3+6HCl=2AlCl3+3H2O;而SiO2不与盐酸反应,过滤得沉淀Ⅰ为二氧化硅,滤液为MgCl2、CaCl2、FeCl3、AlCl3和盐酸的混合液,向滤液中加入一定量10%纯碱溶液,Ca2+、Fe3+、Al3+和碳酸钠溶液反应转化为氢氧化铁、氢氧化铝和碳酸钙沉淀经过滤而除去,反应方程式为CO32- + Ca2+====CaCO3↓,2Fe3+ + 3CO32- + 3H2O ="===" 2Fe(OH)3↓ + 3CO2↑,2Al3+ + 3CO32- + 3H2O====2Al(OH)3↓ + 3CO2↑;向滤液中加足量15%纯碱溶液制得碱式碳酸镁,过滤,回收氯化钠、碳酸钠和碳酸氢钠,碱式碳酸镁煅烧得氧化镁。(1)过滤需要的玻璃仪器有烧杯、漏斗、玻璃棒。(2)根据上述分析知,沉淀Ⅱ的成分为CaCO3、Fe(OH)3、Al(OH)3,用离子方程式表示生成沉淀的过程CO32- + Ca2+====CaCO3↓,2Fe3+ + 3CO32- + 3H2O ="===" 2Fe(OH)3↓ + 3CO2↑,2Al3+ + 3CO32- + 3H2O====2Al(OH)3↓ + 3CO2↑;(3)纯碱溶液中所有离子浓度的大小关系为c(Na+)>c(CO32—)>c(OH-)>c(HCO3—)>c(H+)。(4)利用公式c=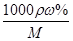 将题给数据代入计算,纯碱溶液的物质的量浓度为1 mo1·L-1。
将题给数据代入计算,纯碱溶液的物质的量浓度为1 mo1·L-1。
考点:考查化学实验基本操作,物质的制备方案的设计、评价,物质的的分离提纯,离子方程式的书写,离子浓度大小比较,物质的量浓度的计算。
本题难度:一般
3、选择题 运用电离常数判断可以发生的反应是
酸
| 电离常数(25oC)
|
碳酸
| Ki1=4.3×10-7? Ki2=5.6×10-11
|
次溴酸
| Ki=2.4×10-9
?
A.HBrO+Na2CO3→NaBrO+NaHCO3
B.2HBrO+Na2CO3→2NaBrO+H2O+CO2↑
C.HBrO+NaHCO3→NaBrO+H2O+CO2↑
D.NaBrO+CO2+H2O→NaHCO3+HBrO
参考答案:AD
本题解析:
试题分析:根据复分解反应中较强酸制备较弱酸的原理,A中次溴酸Ki=2.4×10-9>碳酸Ki2=5.6×10-11,能发生。次溴酸Ki=2.4×10-9<碳酸Ki1=4.3×10-7,可知D能发生,B和C都不能发生。
本题难度:一般
4、填空题 (10分)饱和亚硫酸溶液的pKa(电离平衡常数的负对数,即pKa=-lgKa)数据如下:
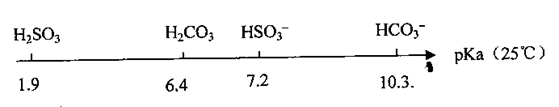
(1)比较H2SO3的Ka1和HSO3-的Ka2,Ka1?????????Ka2(填‘‘>”、“<’’或“=”,下同)
(2)0.01 m ol.L-1NaHSO3溶液的pH=bl,0.01 tml·L-1NaHCO3溶液的pH=b2,
b1?????????b2
(3)向10 mL 0.01 mol·L-1的H2SO3溶液中,滴加0.0l mol·L-1KOH溶液V(mL),
①当V="10" mL时,溶液中存在:c(K+)>c(HSO3-)>c(SO32-)>c(H2SO3),则c(H+)???????????c(OH-)
②当V="a" mL时,溶液中离子浓度有如下关系:c(K+)=2c(SO32-)+c(HSO3-);当V="b" mL时,溶液中离子浓度有如下关系:c(K+)=c(SO32-)+c(HSO3--)+c(H2SO3);则a ?????????????b。
(4)已知25℃时,Ksp(BaSO4)=1×10-10,将0.1 gBaSO4沉淀,分别用100mL蒸馏水和100mL 0.01mo1.L-1H2SO4溶液洗涤,两种洗涤方法中BaSO4沉淀的损耗量之比为????????????.
参考答案:(10分)
(1)>(2分)
(2)<
本题解析:
专题:电离平衡与溶液的pH专题.
分析:(1)根据pKa为电离平衡常数的负对数,即pKa=-lgKa,则pKa越小,电离平衡常数Ka越大;
(2)根据pKa越小,电离平衡常数Ka越大,则对应酸的酸性就强,利用酸越弱则强碱弱酸盐的水解程度越大来分析;
(3)①V=10mL,溶液中的溶质为NaHSO3,由c(HSO3-)>c(SO32-)>c(H2SO3),可知HSO3-的电离大于其水解来分析;
②V="a" mL时由c(K+)=2c(SO32-)+c(HSO3-),则c(H+
本题难度:一般
5、选择题 下列说法正确的是[???? ]
A. pH=2与pH=1的硝酸中c(H+)之比为1: 10
B. Na2CO3溶液中c(Na+)与c(CO32-)之比为2:1
C. 0.2 mol/L与0.1 mol/L醋酸中c(H+)之比为2:1
D. NO2溶于水时,被氧化的NO2与被还原的NO2物质的量之比为3:1
参考答案:A
本题解析:
本题难度:一般
|