微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温下,取0.3 mol/L HY溶液与0.3 mol/L NaOH溶液等体积混合(不计混合后溶液体积变化),测得混合溶液的pH=9,则下列说法(或关系式)正确的是
A.混合溶液中由水电离出来的c(OH-)=1×10-9 mol/L
B.混合溶液中离子浓度大小次序为:c(Y-)>c(Na+)>c(OH-)>c(H+)
C.c(OH-)-c(HY)=c(H+)=1×10-9 mol/L
D.c(Na+)=c(Y-)+c(HY)="0.3" mol/L
参考答案:C
本题解析:
试题分析:等体积混合后,溶液的溶质应该为NaY,浓度应该为0.15mol/L,但是最后溶液显碱性,说明发生了水解。A选项错误,由pH值计算得到氢离子的浓度为1×10-9 mol/L,则氢氧根离子的浓度应该为1×10-5 mol/L。B选项由于NaY发生水解,则c(Y-)<c(Na+),错误。C选项正确,此等式为质子守恒。D选项最后溶液体积为原来的两倍,钠离子的浓度应该是原来的一半,则为0.15mol/L。
点评:本题涉及到了一个难点知识盐类的水解,学生在做题时经常会遇到的问题有离子浓度
本题难度:一般
2、选择题 在盐类水解的过程中,下列说法正确的是
A.盐的电离平衡被破坏
B.水的电离程度一定会增大
C.溶液的pH一定会增大
D.(H+)与c(OH-)的乘积一定会增大
参考答案:B
本题解析:
试题分析:大多数盐都是强电解质,故不存在电离平衡,A不合题意。在盐类水解的过程中,如果是强碱弱酸盐,溶液会显碱性,如果是强酸弱碱盐溶液显酸性,且KW是保持不变的故C、D选项错误。盐类水解的本质就是促进了水的电离程度,打破了水的电离平衡,故 B正确。
点评:此类题目每个选项都是对一类物质的分析比较,可以举出一个反例来进行判断,将题目具体化,将更容易理解。
本题难度:一般
3、选择题 下列叙述正确的是
A.0.1mol·L-1氨水中,c(OH-)=c(NH4+)
B.10mL 0.01 mol·L-1 HCl溶液与10mL 0.01 mol·L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=12
C.在0.1 mol·L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+)
D.0.1 mol·L-1某二元弱酸的强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A)
参考答案:C
本题解析:
正确答案:C
A.不正确,0.1mol·L-1氨水中,OH-来源于水电离和NH3·H2O的电离,c(OH-)>c(NH4+)
B.不正确,[c(OH-)=210mL 0.01 mol·L-1―10mL 0.01 mol·L-1]÷20mL=5×10―3 mol·L-1,则溶液的pH=14―lg5×10―3?<12
C.正确,质子守恒,在0.1 mol·L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+)
D.不正确,物料守恒,A2-中只有
本题难度:一般
4、选择题 常温下,用 0.1 mol·L—1HCl溶液滴定10.0 mL浓度为0.1 mol·L—1 Na2CO3溶液,所得滴定曲线如图所示。下列说法正确的是
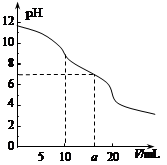
A.当V=0时:c(H+)+c(HCO 3-)+c(H2CO3)=c(OH-)
B.当V=5时:c(CO32—)+c(HCO 3-)+c(H2CO3)=2c(Cl-)
C.当V=10时:c(Na+)>c(HCO 3-)>c(CO32—)>c(H2CO3)
D.当V=a时:c(Na+)>c(Cl-)>c(H+)=c(OH-)
参考答案:BD
本题解析:
试题分析:A、溶液中氢氧根离子和氢离子均是水电离出来的,水电离出的氢离子和氢氧根离子相等,故c(H+)+c(HCO 3-)+2c(H2CO3)=c(OH-),故A错误;B、当V=5时,溶液中加入了0.005mol的氯离子,根据碳元素守恒可得,反应前和反应后溶液中均有n(CO32—)+n(HCO 3-)+n(H2CO3)=0.001mol,故三者的物质的量之和与氯离子的物质的量之比为2:1,故浓度之和等于氯离子浓度之和得2倍,故B正确;C、当V=10时,碳酸钠和盐酸恰好完全反应生成碳酸氢钠,在碳酸氢
本题难度:一般
5、选择题 为了除去MgCl2溶液中的Fe3+,可在加热搅拌的条件下加入的一种试剂是
A.NaOH
B.Na2CO3
C.氨水
D.MgO
参考答案:D
本题解析:
试题分析:选项A、B、C中都能引入新的杂质,不正确。氧化镁能消耗溶液中的氢离子,减弱溶液的酸性,所以可以生成氢氧化铁沉淀而除去,且不会引入杂质,答案选D。
点评:把物质中混有的杂质除去而获得纯净物叫提纯;将相互混在一起的不同物质彼此分开而得到相应组分的各纯净物叫分离。在解答物质分离提纯试题时,选择试剂和实验操作方法应遵循三个原则: 1.不能引入新的杂质(水除外),即分离提纯后的物质应是纯净物(或纯净的溶液),不能有其他物质混入其中;2.分离提纯后的物质状态不变;3.实验过程和操作方法简单易行
本题难度:一般