5.2
?
下列说法中正确的是
A.向氯水中加入NaHCO3溶液,可以增大氯水中次氯酸的浓度
B.四种溶液中,水的电离程度最大的是NaClO
C.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO溶液,pH最大的是H2SO3溶液
D.NaHSO3溶液中离子浓度大小顺序为c(Na+)>c(H+)>c(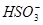 )>c( )>c(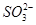 )>c(OH-) )>c(OH-)
参考答案:A
本题解析:依据Cl2+H2O H++Cl-+HClO结合NaHCO3只与H+反应可知A选项正确;水解程度最大的是Na2CO3,B选项错误;相同浓度时,H2SO3的pH最小,C选项错误;c( H++Cl-+HClO结合NaHCO3只与H+反应可知A选项正确;水解程度最大的是Na2CO3,B选项错误;相同浓度时,H2SO3的pH最小,C选项错误;c( 本题难度:一般 本题难度:一般
2、选择题 下列比较中,正确的是(?????)
A.同温度同物质的量浓度时,HF比HCN易电离,则NaF溶液的pH比NaCN溶液大
B.0.2 mol ·L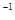 NH4Cl和0.1 mol·L NH4Cl和0.1 mol·L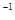 NaOH溶液等体积混合后:c(NH NaOH溶液等体积混合后:c(NH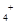 )>c(Cl )>c(Cl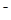 )>c(Na )>c(Na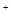 )>c(OH )>c(OH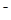 )>c(H )>c(H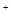 ) )
C.同浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3·H2O;c(NH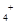 )由大到小的顺序是:①>②>③>④ )由大到小的顺序是:①>②>③>④
D.物质的量浓度相等的H2S和NaHS混合溶液中:c(Na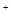 )+c(H )+c(H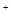 )=c(S )=c(S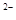 )+c(HS )+c(HS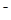 )+c(OH )+c(OH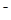 ) )
参考答案:C
本题解析:
正确答案:C
A.不正确, HF比HCN易电离,则NaF溶液的水解能力小,pH比NaCN溶液小。
B.不正确,等体积混合后相当于NH4Cl与NH3·H2O、NaCl等物质的量混合:c(Cl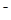 )>c(NH )>c(NH 本题难度:一般 本题难度:一般
3、选择题 下列混合溶液中,各离子浓度的大小顺序正确的是???????(???)
A.10 mL 0.1 mol·L-1氨水与10 mL 0.1 mol·L-1盐酸混合,
c(Cl-)>c(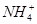 )>c(OH-)>c(H+) )>c(OH-)>c(H+)
B.10 mL 0.1 mol·L-1NH4Cl溶液与5 mL 0.2 mol·L-1NaOH溶液混合,
c(Na+)=c(Cl-)>c(OH-)>c(H+)
C.10 mL 0.1 mol·L-1CH3COOH溶液与5 mL 0.2 mol·L-1NaOH溶液混合,
c(Na+)=c(CH3COO-)>c(OH-)>c(H+)
D.10 mL 0.5 mol·L-1NaOH溶液与6 mL 1 mol·L-1盐酸混合,
c(Cl-)>c(Na+)>c(OH-)>c(H+)
参考答案:B
本题解析:A、恰好中和生成NH4Cl,水解呈酸性,故有c(H+)>c(OH-);
B、恰好反应生成NH3·H2O,只考虑其电离呈碱性;
C、恰好反应生成CH3COONa,CH3COO-水解呈碱性,故Na+)>c(CH3COO-);
D、中和后,盐酸过量,c(H+)>c(OH-);
本题难度:一般
4、选择题 浅绿色的Fe(NO3)2溶液中存在着如下的平衡:Fe 2+?+?2H2O==Fe(OH)2?+?2H+
若往此溶液中加入盐酸,则溶液的颜色(???)
A.绿色变深
B.变得更浅
C.变黄绿色
D.不变
参考答案:C
本题解析:由于硝酸根离子在酸性条件下显强氧化性。当往硝酸亚铁溶液中加入盐酸时,溶液中的亚铁离子被氧化为铁离子,因此溶液呈黄绿色。故正确选项为? C 。??变黄绿色
本题难度:简单
5、选择题 下列判断正确的是 [???? ]
A.酸性溶液中Fe3+、Al3+、NO3-能大量共存
B.AlCl3溶液蒸干后得到的固体是AlCl3
C.在0.1?mol/L?CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+)
D.pH=3的醋酸溶液跟pH=11的氢氧化钡溶液等体积混合后,溶液pH=7
参考答案:AC
本题解析:
本题难度:一般
|