微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)利用反应6NO2+ 8NH3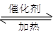 7N2+12 H2O可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是???????L。
7N2+12 H2O可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是???????L。
(2)已知:2SO2(g)+O2(g) 2SO3(g)????????????? ΔH=? —196.6 kJ·mol-1
2SO3(g)????????????? ΔH=? —196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g)????????????? ΔH=? —113.0 kJ·mol-1
2NO2(g)????????????? ΔH=? —113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH=??kJ·mol-1。
SO3(g)+NO(g)的ΔH=??kJ·mol-1。
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是???????。
a.体系压强保持不变??????????????? b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变????? d.每消耗1 mol SO3的同时生成1 molNO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K=?????????。
参考答案:(1)6.72??(2)-41.8;b;8/3
本题解析:(1)在反应6NO2+ 8NH3 7N2+12 H2O中NO2作氧化剂,N化合价由反应前的+4价降低到反应后0价,因此当反应中转移1.2mol电子时,消耗NO2的物质的量为
7N2+12 H2O中NO2作氧化剂,N化合价由反应前的+4价降低到反应后0价,因此当反应中转移1.2mol电子时,消耗NO2的物质的量为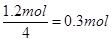 ,所以标准状况下的体积是
,所以标准状况下的体积是 。
。
(2)本题考察盖斯定律的应用、化学平衡状态的判断以及平衡常数的计算。
① 2SO2(g)+O2(g) 2SO3(g)??? ΔH1="-196.6" kJ·mol-1
2SO3(g)??? ΔH1="-196.6" kJ·mol-1
② 2NO(g)+O2(g) 2NO2(g)??? ΔH2="-113.0" kJ·mol-1??。
2NO2(g)??? ΔH2="-113.0" kJ·mol-1??。
②-①即得出2NO2(g)+2SO2(g) 2SO3(g)+2NO(g)? ΔH=ΔH2-ΔH1="-113.0" kJ·mol-1 +196.6 kJ·mol-1=+83.6kJ·mol-1。所以本题的正确答案是41.8;
2SO3(g)+2NO(g)? ΔH=ΔH2-ΔH1="-113.0" kJ·mol-1 +196.6 kJ·mol-1=+83.6kJ·mol-1。所以本题的正确答案是41.8;
反应NO2(g)+SO2(g) SO3(g)+NO(g)的特点体积不变的、吸热的可逆反应,因此a不能说明。颜色的深浅与气体的浓度大小有关,而在反应体系中只有二氧化氮是红棕色气体,所以混合气体颜色保持不变时即说明NO2的浓度不再发生变化,因此b可以说明;SO3和NO是生成物,因此在任何情况下二者的体积比总是满足1:1,c不能说明;SO3和NO2一个作为生成物,一个作为反应物,因此在任何情况下每消耗1 mol SO3的同时必然会生成1 molNO2,因此d也不能说明;
SO3(g)+NO(g)的特点体积不变的、吸热的可逆反应,因此a不能说明。颜色的深浅与气体的浓度大小有关,而在反应体系中只有二氧化氮是红棕色气体,所以混合气体颜色保持不变时即说明NO2的浓度不再发生变化,因此b可以说明;SO3和NO是生成物,因此在任何情况下二者的体积比总是满足1:1,c不能说明;SO3和NO2一个作为生成物,一个作为反应物,因此在任何情况下每消耗1 mol SO3的同时必然会生成1 molNO2,因此d也不能说明;
设NO2的物质的量为1mol,则SO2的物质的量为2mol,参加反应的NO2的物质的量为xmol。

本题难度:一般
2、选择题 在CuCl2水溶液中存在如下平衡:[Cu(H2O)4]2+(蓝)+4Cl-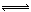 [CuCl4]2-(绿)+4H2O能使黄绿色CuCl2溶液向蓝色转化的操作是
[CuCl4]2-(绿)+4H2O能使黄绿色CuCl2溶液向蓝色转化的操作是
A.蒸发浓缩
B.加CuCl2固体
C.加入AgNO3
D.加入食盐晶体
参考答案:C
本题解析:使黄绿色CuCl2溶液向蓝色转化,即平衡左移,加入AgNO3,可以减小氯离子浓度,平衡左移。蒸发浓缩、加入氯离子均使平衡右移。
本题难度:简单
3、选择题 在2L的密闭容器中,发生3A(g)+B(g) 2C(g)的反应,若最初加入A和B都是4mol,测得10s内A的平均速率v(A)=0.12mol/(L·s),则反应进行到10s时容器中B的物质的量是[???? ]
2C(g)的反应,若最初加入A和B都是4mol,测得10s内A的平均速率v(A)=0.12mol/(L·s),则反应进行到10s时容器中B的物质的量是[???? ]
A.1.6mol
B.2.8mol
C.3.2mol
D.3.6mol
参考答案:C
本题解析:
本题难度:简单
4、填空题 T℃时,A、B、C三种气体在反应过程中的浓度变化如图1所示,若保持其它条件不变,温度分别为T1℃和T2℃时,B的浓度变化与时间的关系示意图如图2所示。
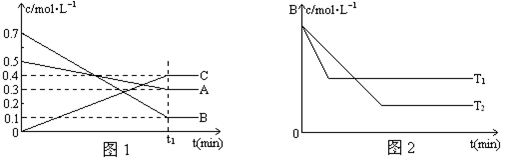
请回答下列问题:
(1)该反应的化学反应方程式是:?????????????????????????????????
(2)比较大小:
A和B的转化率A??????????B,原因是????????????????????????????????????????????
温度的高低T1??????????T2,判断依据是???????????????????????????????????????????
(3)若其它条件不变,反应进行到(t1+10)min时,A的浓度为????????????????
参考答案:(6分)每空1分?????(1)A(g) + 3B(g)
本题解析:
试题分析:(1)由图(Ⅰ)可知,A和B的物质的量浓度减小,C的物质的量浓度增加,则A、B为反应物,C为生成物,由反应的浓度的变化之比等于化学计量数之比可得:△c(A):△c(B):△c(C)=0.2mol/L:0.6mol/L:0.4mol/L=1:3:2,则反应的化学方程式为A+3B 2C。
2C。
(2)由于加入的A、B浓度比(5:7或1:1.4)大于参加反应的A、B浓度比(1:3),即相当于是增加A的浓度,平衡向正反应方向移动,所以提高B的转化率,即A的转化率低于B的转化率。从图2判断,T1时,达到平衡的时间短,说明反应速率快,所以温度高,因此稳定是T1>T2。
(3)根据图像可知,反应进行到T1时反应就已经达到平衡状态,所以若其它条件不变,反应进行到(t1+10)min时,A的浓度为不变,仍然是0.3mol/L。
点评:该题是高考中的常见题型,属于中等难度的试题。解答该题时注意分析图象的曲线变化特点,由图象得出反应的化学方程式为解答该题的关键。难点是A和B转化率的定性分析,另外A和B转化率的判断,也可以通过定量计算进行判断。
本题难度:一般
5、填空题 (6分)将物质的量均为2. 00mol的物质X、Y混合,发生如下反应:2X+Y 2W。在反应过程中W的物质的量分数随温度变化如图所示:
2W。在反应过程中W的物质的量分数随温度变化如图所示:
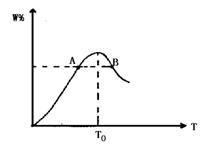
(1)T0对应的V正和V逆的关系是V正??????V逆(填“>”、“<”或“=”);
(2)此反应的正反应为?????????热反应;
(3)A、B两点正反应速率的大小关系是A?????B(填“>”、“<”或“=”);
参考答案:每空2分(1)等于(2)放
本题解析:略
本题难度:一般