微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列叙述正确的是 [???? ]
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.由C(石墨)→C(金刚石)-1.19kJ/mol可知,金刚石比石墨稳定
C.在稀溶液中:H+(aq)+OH-(aq)→H2O(l)+57.3kJ,若将含0.1mol?醋酸的溶液与含0.1?mol?氢氧化钠的溶液混合,放出的热量小于5.73kJ?
D.在101.3kPa时,2g?H2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)→2H2O(l)+285.8kJ
参考答案:C
本题解析:
本题难度:一般
2、填空题 某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5 的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。
的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。
请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。
若测得该试样所含离子的化学组分及其浓度如下表:
离子
| H+
| K+
| Na+
| NH4+
| SO42-
| NO3-
| Cl-
|
浓度/mol·L-1
| 未测定
| 4×10-6
| 6×10-6
| 2×10-5
| 4×10-5
| 3×10-5
| 2×10-5
根据表中数据判断试样的pH= 。
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+1/2O2(g)=H2O(g) △H=-241.8kJ·mol-1
C(s)+1/2O2(g)="CO" (g) △H=-110.5kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式: 。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是 。
A.Ca(OH) 2 B.Na2CO3 C.CaCl2D.NaHSO3
(3)汽车尾气中有NOx和CO的生成及转化
① 若1mol空气含0.8molN2和0.2molO2,汽缸中的化学反应式为N2 (g)+O2(g)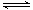 2NO(g) △H 2NO(g) △H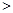 0 0
1300℃时将1mol空气放在密闭容器内反应达到平衡,测得NO为8×10-4mol。计算该温度下的平衡常数K= 。
汽车启动后,汽缸温度越高,单位时间内NO排放量越大,其原因是 。
②目前,在汽车尾气系统中装置催化转化器可减少CO和NOx的污染,其化学反应方程式为 。
③ 汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO,2CO(g)=2C(s)+O2(g)
已知该反应的△H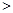 0,判断该设想能否实现并简述其依据: 。 0,判断该设想能否实现并简述其依据: 。
参考答案:(1)PH=4
(2)①C(s)+H2O(g)=H2(
本题解析:
试题分析:(1)根据溶液呈电中性的原理可得c(H+)+c(K+)+c(Na+)+c(NH4+)=2c(SO42-)+c(NO3-)+c(Cl-)。将各个数值代入上述式子可得c(H+)=1.0×10-4mol/L,所以pH=4;(2)① ②-①整理可得C(s)+H2O(g)=H2(g)+CO(g) △H=+131.3kJ/mol;②A.Ca(OH) 2+ SO2=CaSO3↓+H2O;正确。B.Na2CO3+ SO2=Na2SO3+ CO2。正确。C.CaCl2不反应,不能作吸收剂,错误。D.NaHSO3不反应,不能作吸收剂,错误。(3)①在反应开始时,n(N2)=0.8mol;n(O2)=0.2mol;n(NO)=0;当反应达到平衡时,n(N2)=(0.8-4×10-4)mol
n(O2)=(0.2-4×10-4)mol; n(NO)= 8×10-4mol.假设气缸的容积为VL。则该温度下的平衡常数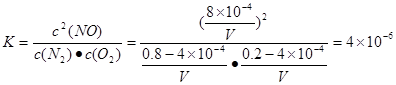 。汽车启动后,汽缸温度越高,单位时间内NO排放量越大,是因为升高温度,化学反应速率加快。②根据已知条件结合质量守恒定律可得反应方程式为:2XCO+2NOX 。汽车启动后,汽缸温度越高,单位时间内NO排放量越大,是因为升高温度,化学反应速率加快。②根据已知条件结合质量守恒定律可得反应方程式为:2XCO+2NOX  2XCO2+N2。③由于反应2CO(g)=2C(s)+O2(g)△H>0是个体系混乱程度减小的吸热反应。ΔH>0;△S<0,根据体系的自由能ΔG=ΔH-T·ΔS>0,.所以该设想 不能实现。 2XCO2+N2。③由于反应2CO(g)=2C(s)+O2(g)△H>0是个体系混乱程度减小的吸热反应。ΔH>0;△S<0,根据体系的自由能ΔG=ΔH-T·ΔS>0,.所以该设想 不能实现。
考点:考查溶液的电荷守恒、热化学方程式的书写、化学平衡常数的计算、反应的自发性的判断的知识。
本题难度:困难
3、填空题 (16分)选择适当的催化剂在高温下可将汽车尾气中的 CO、NO转化为无毒气体。
(1)已知:①2CO(g)+O2(g)=2CO2(g) ?H1="a" kJ?mol-1
②2NO(g)+2CO(g) ?N2(g)+ 2CO2(g) ?H2="b" kJ?mol-1
则反应N2(g)+ O2(g)= 2NO(g)的?H= kJ?mol-1(用a、b表示)。
(2)在一定温度下,向1L密闭容器中充入0.5 mol NO、2 mol CO,发生上述反应②,20S反应达平衡,此时CO的物质的量为1.6 mol。请回答下列问题:
①前20S内平均反应速率v(NO)为 。
②在该温度下反应的平衡常数K= 。
③关于上述反应,下列叙述不正确的是 (填编号)。
A.达到平衡时,移走部分CO2,平衡将向右移动,正反应速率加快
B.缩小容器的体积,平衡将向右移动
C.在相同的条件下,若使用甲催化剂能使正反应速率加快105倍,使用乙催化剂能使逆反应速率加快108倍,则应该选用乙催化剂
D.若保持平衡时的温度和压强不变,再向容器中充入0.4molCO和0.8mol N2,则此时v正>v逆
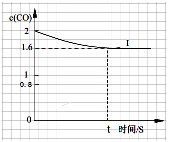
④已知上述实验中,c(CO)与反应时间t变化曲线Ⅰ。若其它条件不变,将0.5 mol NO、2 mol CO投入2 L容器进行反应,请在答题卡图中绘出c(CO)与反应时间t1变化曲线Ⅱ。
(3)测试某汽车冷启动时的尾气催化处理CO、NO百分含量随时间变化曲线如下图
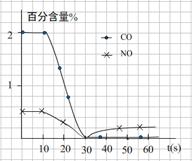
请回答:前0—10 s 阶段,CO、NO百分含量没明显变化的原因是 。
参考答案:(16分)
(1)a-b (2分)
(
本题解析:
试题分析:(1)根据盖斯定律,反应N2(g)+ O2(g)= 2NO(g)的?H=?H1—?H2=(a-b)kJ?mol-1。
(2)①根据三段式进行计算,2NO(g)+2CO(g) ?N2(g)+ 2CO2(g)
初始浓度(mol?L?1) 0.5 2 0 0
转化浓度(mol?L?1) 0.4 0.4 0.2 0.4
平衡浓度(mol?L?1) 0.1 1.6 0.2 0.4
则前20S内平均反应速率v(NO)=0.4mol/L÷20S=0.02mol·L-1·S-1。
②该温度下反应的平衡常数K=0.2×0.42÷(0.12×1.62)=1.25。
③A、达到平衡时,移走部分CO2,生成物浓度减小,平衡将向右移动,反应物浓度逐渐减小,正反应速率减小,故A错误;B、缩小容器的体积,气体的压强增大,平衡将向右移动,故B正确;C、因为催化剂能同等倍数的增大正反应速率和逆反应速率,所以应选用乙催化剂,故C正确;D、若保持平衡时的温度和压强不变,再向容器中充入0.4molCO和0.8mol N2,则浓度商Q=1×0.42÷(0.12×1.62)="4" >K,所以反应向左进行,即v正 < v逆,故D错误。
④将0.5 mol NO、2 mol CO投入2 L容器进行反应,则起始时CO的浓度为1mol?L?1,因为起始浓度变为原反应的1/2,所以反应速率减小,则达到化学平衡的时间变长,因为容积为2L,为原反应的2倍,所以压强减小,平衡向左移动,则c(CO) > 0.8,可画出图像。
(3)催化剂的催化作用需要在一定温度下才能充分体现出来,所以前0—10 s 阶段,CO、NO百分含量没明显变化的原因是:尚未达到催化剂工作温度(或尚未达到反应的温度)。
考点:本题考查盖斯定律的应用、化学反应速率、化学平衡移动及计算、图像的分析及绘制。
本题难度:困难
4、选择题 下列热化学方程式中,放出的热量最多的是[???? ]
A.CH4(g)+2O2(g) == CO2(g)+2H2O(1) △H
B.2CH4(g)+4O2(g) == 2CO2(g)+4H2O(1) △H
C.CH4(g)+2O2(g) == CO2(g)+2H2O(g) △H
D.2CH4(g)+4O2(g) == 2CO2(g)+4H2O(g) △H
参考答案:B
本题解析:
本题难度:简单
5、选择题 下列图示与对应的叙述相符的是

A.图1表示盐酸滴加到0.1 mol·L-1某碱溶液得到的滴定曲线,用已知浓度盐酸滴定未知浓度该碱时最好选取酚酞作指示剂。
B.图2表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂。
C.图3表示工业上用CO生产甲醇的反应CO(g)+2H2(g) CH3OH(g),该反应的ΔH=-91kJ/mol。 CH3OH(g),该反应的ΔH=-91kJ/mol。
D.图4表示物质的量之比为2∶3的镁和铝分别与过量稀硫酸反应时,产生气体的体积(V)与时间(t)的关系。
参考答案:C
本题解析:
试题分析:A、盐酸滴定碱溶液时,无论碱是强碱还是弱碱,滴定后的溶液均呈弱酸性,所以最好选择甲基橙作指示剂,错误;B、反应速率增大,但平衡不移动,不一定是加入催化剂,可能是增大压强,对于反应前后气体的物质的量不变的可逆反应而言,增大压强,平衡不移动,但反应速率增大,错误;C、根据图像可知该反应的反应热为(419-510)kJ/mol=-91kJ/mol,正确;D、物质的量之比为2∶3的镁和铝分别与过量稀硫酸反应时,产生的氢气的体积比是2:4.5,不是1:1,错误,答案选C。
考点:考查对图像的分析判断
本题难度:一般
|