微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 有一种pH为12的NaOH溶液100mL,要使它的pH降到11,
(1)如果加入蒸馏水,应加________mL。(溶液总体积允许相加。下同)
(2)如果加入pH=l0的NaOH溶液,应加_______mL。
(3)如果加入0.0l mol·L-1的盐酸,应加_______mL。
2、选择题 甲溶液的PH为4,乙溶液的PH为2,则甲、乙两溶液的c(H+)的大小为[???? ]
A.甲>乙
B.甲=乙
C.甲<乙
D.无法判断
3、填空题 (1)已知:
Fe(s)+1/2O2(g)=FeO(s)
2Al(s)+3/2O2(g)= Al2O3(s)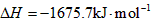
Al和FeO发生铝热反应的热化学方程式是 ____________________________________。
(2)反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,如下图所示。?
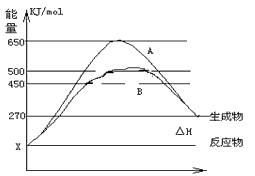
①据图判断该反应是_____(填“吸”或“放”) 热反应,当反应达到平衡后,其他条件不变,升高温度,反应物的转化率____ (填“增大”、“减小”或“不变”)
②其中B历程表明此反应采用的条件为______ (选填下列序号字母)
A.升高温度 B.增大反应物的浓度 C.降低温度 D.使用了催化剂
(3)1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(s) + 4H2(g) 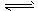 Na2S(s) + 4H2O(g) 。 ①该反应的平衡常数表达式为____________________。已知K1000℃<K1200℃,则该反应是________反应(填“吸热”或“放热”)。
Na2S(s) + 4H2O(g) 。 ①该反应的平衡常数表达式为____________________。已知K1000℃<K1200℃,则该反应是________反应(填“吸热”或“放热”)。
②用有关离子方程式说明上述反应所得固体产物的水溶液的酸碱性____________ 。
(4)常温下,如果取0.1mol·L-1 HA溶液与0.1mol·L-1 NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8,请回答下列问题:
①混合溶液中水电离出的c(H+)与0.1mol·L-1 NaOH溶液中水电离出的c(H+)比较 ________(填<、>、=)。
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH ________7(填<、>、=);相同温度下,等物质的量浓度的下列盐溶液按pH由大到小的排列顺序为_______________ 。(填序号)
a..NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl
4、填空题 测试和调控溶液的PH ,对工农业生产、科学研究等有重要的意义,完成下列关于PH 的计算和比较。
(1)?常温下,下列溶液中PH由大到小的顺序是_____________?。水电离出的c(OH-)由大到小的顺序是:________________________????
?① 0.1 mol/L NaOH 溶液????????② 0.1 mol/L Ba(OH)2溶液?????????? ③??0.1 mol/L CH3COOH 溶液??????????④ 0.1 mol/L HCl溶液????????⑤ 0.1 mol/L NH4Cl溶液???????????????????????????????
(2)?水的电离平衡曲线如图所示
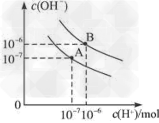
①若以A点表示25℃时水的电离平衡的离子浓度,当温度升高到95℃时,水的电离平衡状态移动到B点,则此时水的离子积从________变化到_________。
②??将pH=8 的Ba(OH)2溶液与pH=5 的稀盐酸混合,并保95 ℃的恒温,若混合溶液呈中性,则Ba(OH)2和盐酸的体积比为__________________ 。
(3)一定温度下,有a 、盐酸;b 、硫酸;c 、醋酸三种酸的稀溶液。( 用a 、b 、c 、<、=、>号填写)
①同体积同物质的量浓度的三种酸,中和NaOH 能力的顺序是_____ ,
②当其c(H+) 相同时,物质的量浓度由大到小的顺序为___________ ,
③当c(H+) 相同、体积相同时,分别加入足量相等表面积的锌,反应开始时的速率大小为:?????????? ??,相同状况产生的气体体积由大到小的顺序为__________________ 。
④将c(H+) 相同的三种酸均稀释10 倍,c(H+) 由大到小的顺序为______ 。
5、选择题 下列说法正确的是[???? ]
A.t°C时,某溶液的PH=6,则该溶液一定为酸性
B.欲制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸
C.由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定
D.甘油不是油,纯碱不是碱,酚醛树脂不是酯,干冰不是冰