?
?
(2)完成步骤1后,检验铜粉中的铁是否除尽的实验操作是___________。
(3)若胆矾中含有少量Cu(NO3)2·3H2O,测定其中CuSO4·5H2O的含量,实验步骤如下:称量胆矾样品的质量为m1,加水溶解,滴加足量BaCl2溶液,充分反应后过滤,将滤渣烘干、冷却,称得其质量为m2。样品中CuSO4·5H2O的质量分数为________(列出算式)。
参考答案:(1)
实验步骤
预期现象
步骤1:加入足
本题解析:(1)制备胆矾的实验设计:根据所给试剂,由于铜不能直接与稀硫酸反应,因此需要氧化剂(H2O2或HNO3)将铜氧化为Cu2+,Cu2+对H2O2的分解有催化作用,因此只能用浓硝酸氧化,但如果直接用浓硝酸氧化生成Cu(NO3)2,再和硫酸通过复分解反应制备CuSO4,会增大HNO3的用量且会引入Cu(NO3)2杂质。因此实验中借助反应:3Cu+8H++2NO===3Cu2++2NO↑+4H2O,即先加硫酸,再加浓硝酸。(2)检验铜中的铁粉是否除尽,还可以通过检验最后一次硫酸洗涤液中是否含有Fe2+来确定。
(3)CuSO4·5H2O ~ BaSO4
250 ?? ? 233
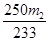 ????? m2 ????? m2
则样品中CuSO4·5H2O的质量分数为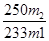 ×100%。 ×100%。
本题难度:一般
2、实验题 实验室常见的几种气体发生装置A、B、C所示:
  (1)实验室可以用B和C装置制取氨气,如果用C装置,通常使用的药品是??????????????。检查C装置气密性是否良好的操作方法是?????????????????????????????????????????????????? (1)实验室可以用B和C装置制取氨气,如果用C装置,通常使用的药品是??????????????。检查C装置气密性是否良好的操作方法是??????????????????????????????????????????????????
????????????????????????????????????????????????????????????????????。
(2)气体的性质是气体收集方法选择的主要依据。下列性质与收集方法无关的是??????
????????????(填序号,下同)
①密度??②颜色??③溶解性??④热稳定性??⑤与氧气反应
(3)若用A装置与D装置相连制取并收集X气体,则X可能是下列气体中的??????。
①CO2????②NO????③Cl2????④H2
参考答案:(1)浓氨水、CaO固体(NaOH固体或碱石灰);将导管与一
本题解析:(1)利用装置C的特点,不需要加热来制取氨气,则可选用浓氨水、CaO固体(NaOH固体或碱石灰);装置C气密性的检验方法为:将导管与一导管连接,其末端放入水中,关闭分液漏斗活塞,用手(或热毛巾)捂住烧瓶,若导管末端有气泡产生,移开手(或热毛巾),若水中的导管产生一段水柱,则装置的气密性良好;(2)气体收集时,要依据气体的密度的大小(如H2、Cl2)、是否溶解于水(如H2、HCl)、是否与氧气反应(若NO)等来选择判断收集方法;(3)利用装置A制取的气体需要加热,利用装置D收集的气体是密度比空气的大的,则依据这两个条件,提起③Cl2符合。
本题难度:简单
3、实验题 某化学兴趣小组在学习“硫的化合物的某些性质”中,进行了如下实验:
【实验一】探究SO2的性质,
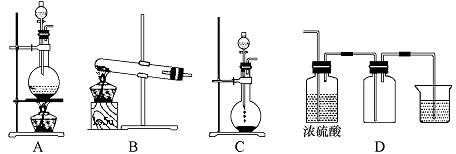
按下图所示装置进行实验。

请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是?????????????,其中发生反应的化学方程式为????????????????????;
(2)实验过程中,装置B、C中发生的现象分别是??????????????????、???????????????,这些现象分别说明SO2具有的性质是?????????和??????????;装置B中发生反应的离子方程式为??????????????????????????;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象???????????????????
______________________________________________;
(4)该装置有一明显缺陷,请指明_______________________,并在框图内画出补充装置(注明药品)。

【实验二】验证足量锌与浓硫酸反应产生的气体成分是二氧化硫和氢气。按下图装置进行实验(锌与浓硫酸共热时产生的气体为X,且该装置略去)。试回答:
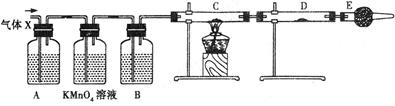
(5)A中加入的试剂可能是____________,作用是_______________;
B中加入的试剂可能是____________,作用是_______________;
E中加入的试剂可能是____________,作用是_______________。
(6)可以证明气体X中含有氢气的实验现象是:C中:____________,D中:__________;
参考答案:(20分)【实验一】(1)蒸馏烧瓶??Na2SO3+H2SO
本题解析:(4 分)(1)0.04?? (2)26.7
试题分析:【实验一】(1)根据仪器的结构可知,装置A中盛放亚硫酸钠的仪器名称是蒸馏烧瓶,其中发生反应的化学方程式是Na2SO3+H2SO4(浓)=Na2SO4+SO2↑。
(2)SO2具有还原性,能被酸性高锰酸钾溶液氧化,所以B中现象是溶液由紫红色变为无色,反应的离子方程式是5SO2+2MnO4-+2H2O=5SO42- +2Mn2++4H+。SO2也具有氧化性,能把硫化钠氧化生成单质S沉淀,所以C中现象是无色溶液出现黄色浑浊。
(3)SO2的漂白是不稳定的,加热又能挥发原来的颜色,所以要探究SO2与品红作用的可逆性,实验操作及现象是品红溶液褪色后,关闭分液漏斗活塞,点燃D处酒精灯加热,溶液恢复红色。
(4)SO2是大气污染物,缺少尾气吸收装置。
【实验二】(5)检验SO2的试剂是品红溶液,则A中的试剂是品红溶液,用来检验SO2。由于气体中含有水蒸气,会干扰氢气的检验,因此B中的试剂浓硫酸,用来吸收水蒸气。另外空气中也含有水蒸气,剩余E中应该盛放碱石灰,用来防上空气中水蒸气进入D中。
(6)氢气还原氧化铜生成铜和水蒸气,所以可以证明气体X中含有氢气的实验现象是:C中黑色粉末(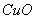 )变成红色 )变成红色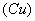 ;D中白色粉末变成蓝色。2的制备、检验、性质以及漂白性探究 ;D中白色粉末变成蓝色。2的制备、检验、性质以及漂白性探究
点评:该题是高考中的常见题型,难度大,综合性强,对学生的要求高。试题在注重对基础知识巩固和训练的同时,侧重对学生能力的培养和解题方法的指导与训练,有利于培养学生规范严谨的实验设计能力以及评价能力。该类试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。
本题难度:一般
4、简答题 某学生用图示的装置进行一氧化碳和二氧化碳混合气体的分离和干燥.其中a为铁夹,b为分液漏斗的活塞.
(1)甲瓶内盛______?溶液,乙瓶内盛______溶液,分液漏斗内盛______溶液.
(2)实验先分离出一氧化碳,方法是先关闭______,再打开______.
(3)分离完一氧化碳后,再收集二氧化碳,方法是先关闭______,再打开______.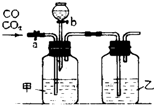
参考答案:(1)依据实验要求可知甲、乙装置应分别为除杂和干燥装置,根据
本题解析:
本题难度:一般
5、填空题 (Ⅰ)某化学兴趣小组的同学得上用下 图所示实验装置进行实验(图中a、b、c表示止水夹)。 图所示实验装置进行实验(图中a、b、c表示止水夹)。
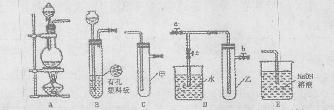
(1)请利用上述装置设计一个简单的实验验证Cl-和Br-的还原性强弱。
①选择合理的装置连接:???????????→????????????→??????????(填字母编号)。
②选择所需的试剂:??????????(填字母编号)。
a.固体氯化钠??? b.固体二氧化锰??? c.浓硫酸
d.浓盐酸??????? e.稀盐酸????????? f.溴化钠溶液
③实验现象及结论:?????????。
(Ⅱ)电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行资源回收并制备NiSO4·7H2O晶体,设计实验流程如下:

已知:①NiSO4易溶于水,Fe3+不能氧化Ni2+
②某温度下一些金属氢氧化物的KSP及析出理论pH如下表所示:
M(OH)n
| Ksp[来
| pH
| 开始沉淀
| 沉淀完全
| Al(OH)3
| 1.9×10-23
| 3.43
| 4.19
| Fe(OH)3
| 3.8×10-38
| 2.53
| 2.94
| Ni(OH)2
| 1.6×10-14
| 7.60
| 9.75
???回答下列问题:
(1)根据上表数据判断操作2依次析出的沉淀I是???????沉淀II是????????(填化学式),pH1???????????pH2(填“>”、“<”或“=”);
(2)操作1和操作2所用到的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的主要仪器为???????????。
(3)“调节pH为2-3”的目的是???????;
(4)NiSO4在强碱溶溶中用NaClO氧化,可制得碱性镍镉电池电极材料——NiOOH。该反应的离子方程式是??????????????。
参考答案: 本题解析:略 本题解析:略
本题难度:一般
|
|