微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)某学生实验小组拟用孔雀石(主要成分是Cu(OH)2·CuC03,其杂质主要为FeC03等)制胆矾,实验设计流程如下:

回答下列问题:
(1)步骤(a)中,实验研磨孔雀石的仪器名称??????????;用硫酸浸取的化学方程式:??????????????????????
(2)步骤(b)中,pH控制在3.O~3.5,其目的是????????????????????????;加过氧化氢发生反应的离子方程式为???????????????????????????????????????????????。
(3)怎样判断蒸发浓缩已完成:??????????????????????????????????????????。
(4)将制得的样品用热重仪进行热重分析,热重仪原理及热重记录如下表:
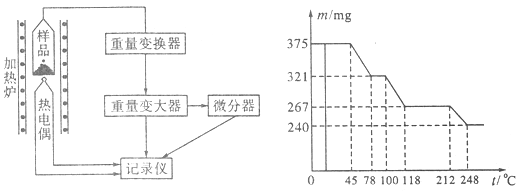
写出212~248℃温度范围内发生反应的化学方程式??????????????????????????????。
(5) FeC03为白色沉淀,此沉淀的Ksp(FeC03)=2×10-11,将FeCl2的稀溶液与Na2CO3溶液等体积混合,若FeCl2的浓度为2×lO一5mol·L-1.则生成沉淀所需Na2CO3溶液的最小浓度为????mol·L-1。
参考答案:(1)研钵??? Cu(OH)2·CuCO3+2H2SO4=
本题解析:(1)固体研磨需要在研钵中进行。氢氧化铜或碳酸铜都能和硫酸反应,方程式为Cu(OH)2·CuCO3+2H2SO4=2CuSO4+3H2O+CO2↑。
(2)双氧水具有氧化性,能把亚铁离子氧化生成铁离子,方程式为2Fe2++H2O2+2H+=2Fe3++2H2O。在pH=3.0~5.0的范围内铁离子能完全沉淀,而铁离子留在溶液中。
(3)蒸发时如果发现液面有晶体析出时,即可说明蒸发浓缩已完成。
(4)胆矾是375mg,物质的量是0.0015mol,其中水的质量是0.135mg。在221℃固体减少的质量是375mg-267mg=108mg,这说明减少的质量是水的质量,所以减少的水的物质的量是0.0015mol,所以此时固体是CuSO4·H2O,由212℃到248℃,固体又减少0.027mg,即此时固体中已经没有结晶水了,所以反应的方程式为CuSO4·H2O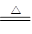 CuSO4+H2O。
CuSO4+H2O。
(5)等体积混合后,亚铁离子的浓度变为1×lO一5mol·L-1.根据溶度积常数的表达式可知c(CO32-)=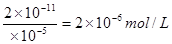 ,所以原碳酸钠溶液的浓度是4×lO一6mol/L。
,所以原碳酸钠溶液的浓度是4×lO一6mol/L。
本题难度:一般
2、选择题 实验室可用下列方法制取气体,其中必须用排水法收集的是( )
A.锌与稀硫酸反应
B.碳酸钙与稀盐酸反应
C.铜片与稀硝酸反应
D.二氧化锰与双氧水混合
参考答案:A、氢气在空气中能稳定存在且密度明显小于空气的密度,所以可用
本题解析:
本题难度:简单
3、实验题 (10)按要求完成硝酸钾晶体的制备实验:
步骤
| 操作
| 具体操作步骤
| 现象解释结论等
|
?
①
| 溶解
| 取20克NaNO3和17克KCl溶解在35ml水中,加热至沸,并不断搅拌。
| 固体溶解
|
②
| 蒸发
| 继续加热搅拌,使溶液蒸发浓缩。
| 有????a??????晶体析出。
|
③
| 热过滤
| 当溶液体积减少到约原来的一半时,迅速趁热过滤
| 滤液中的最主要成分为???b????。
|
④
| 冷却
| 将滤液冷却至室温。
| 有晶体析出。
|
 ⑤ ⑤
| ?
| 按有关要求进行操作
| 得到初产品硝酸钾晶体
|
⑥
| ?
| 将得到的初产品硝酸钾晶体溶于适量的水中,加热、搅拌,待全部溶解后停止加热,使溶液冷却至室温后抽滤。
| ?
得到纯度较高的硝酸钾晶体
|
⑦
| ?
检验
| 分别取⑤、⑥得到的产品,配置成溶液后分别加入1滴1mol/l的HNO3和2滴0.1mol/l的AgNO3
| 可观察到⑤、⑥产品中出现的现象分别是⑤产品中产生白色沉淀,⑥产品中无明显现象。
(1)把上述各步骤中的内容补充完整:a: b: ?
(2)写出步骤③趁热过滤的目的??????????????????,步骤⑥的操作名称?????????,步骤⑦中产生白色沉淀的离子方程式???????????????????????????
(3)步骤⑥的抽滤装置如图所示,仪器A的名称?????????,该装置中的错误之处是???????????;抽滤完毕或中途需停抽滤时,应先???????????????,然后??????????????。
参考答案:(1)NaCl;??? KNO3
(2)防止因温度降低
本题解析:(1)氯化钠的溶解度小,蒸发浓缩首先写出氯化钠,即a是氯化钠。硝酸钾的溶解度受温度影响大,所以降低温度时氯化钠析出,则b是硝酸钾。
(2)步骤③趁热过滤的目的防止因温度降低而析出硝酸钾晶体。为了得到纯净的硝酸钾晶体,需要重结晶。氯离子能和银离子反应生成氯化银沉淀,方程式为Ag++ Cl-= AgCl↓。
(3)根据仪器结构特点可知,A是布氏漏斗,抽滤时布氏漏斗的颈口斜面未朝向抽滤瓶的支管口,所以该处是错误的。抽滤完毕或中途需停抽滤时,应先断开连接安全瓶与抽气装置间的橡皮管,然后再关闭抽气装置的水龙头。
本题难度:一般
4、选择题 下列气体不能用H2SO4干燥的是 [???? ]
A.CO2
B.NH3
C.SO2
D.HC1
参考答案:B
本题解析:
本题难度:简单
5、选择题 下列说法正确的是[???? ]
A.实验室可用加热分解碳酸钙的方法制取二氧化碳气体
B.二氧化硫易溶于水,硫酸工厂的尾气可以直接用水吸收
C.二氧化氮可与水反应而被吸收,故硝酸工业的尾气应该用水吸收
D.配制较高浓度的碘水时,应先将碘溶于酒精中,再加水稀释
参考答案:D
本题解析:
本题难度:简单
|