微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害。某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:
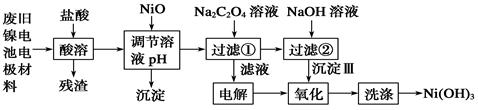
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。②K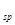 (Ni(OH)
(Ni(OH)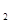 ): 5.0×10-16 ,K
): 5.0×10-16 ,K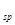 (NiC2O4): 4.0×10-10
(NiC2O4): 4.0×10-10
回答下列问题:
(1)酸溶后所留残渣的主要成份 (填物质名称)。
(2)用NiO调节溶液的pH,析出沉淀的成分为____________________(填化学式);用pH试纸测定某溶液pH的具体操作是 。
(3)写出加入Na2C2O4溶液后反应的化学方程式_____________________________。
(4)写出加入NaOH溶液所发生反应的离子方程式 ,该反应的平衡常数为 。
(5)沉淀Ⅲ可被电解所得产物之一 (填化学式)氧化生成Ni(OH)3 ,如何洗涤Ni(OH)3 沉淀?
。
参考答案:(1)碳粉
(2)Fe(OH)3、Al(OH)3 把干
本题解析:
试题分析:(1)由于电极材料是由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成的,因此在这些成分中不溶于酸的只有碳粉,所以酸溶后所留残渣为碳粉。
(2)酸溶后的溶液中含有Al3+ 、Fe3+ 、Ni2+ 等金属离子,因此加入NiO主要是调节pH值使杂质离子Al3+ 、Fe3+ 沉淀,所以析出的沉淀为Fe(OH)3、Al(OH)3 。用pH试纸测定溶液pH值的操作是:把干燥pH试纸置于表面皿(或玻璃片)上,用干燥洁净的玻璃棒蘸取待测液滴在pH试纸上,待显色后立即与标准比色卡比对即可读数。
(3)除去Al3+ 、Fe3+ 等杂质离子后的溶液为NiCl2 溶液,加入Na2C2O4溶液后又经过了过滤步骤,可以推测此步骤中反应有沉淀析出,因此发生的反应方程式为NiCl2+Na2C2O4==NiC2O4↓+2NaCl。
(4)加NaOH溶液到NiC2O4 沉淀中,根据已知条件中Ni(OH)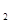 、NiC2O4的溶度积,可以分析两种沉淀的溶解度较接近,因此此处应该是发生了沉淀的转化反应,所以方程式为NiC2O4 +2OH-
、NiC2O4的溶度积,可以分析两种沉淀的溶解度较接近,因此此处应该是发生了沉淀的转化反应,所以方程式为NiC2O4 +2OH- 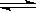 Ni(OH)2+C2O42- ,此转化方程式可由两沉淀的溶解平衡式结合而得:
Ni(OH)2+C2O42- ,此转化方程式可由两沉淀的溶解平衡式结合而得:
①Ni(OH)2 = Ni2+ +2OH- K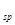 (Ni(OH)
(Ni(OH)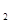 )= 5.0×10-16 ②NiC2O4 = Ni2+ + C2O42- K
)= 5.0×10-16 ②NiC2O4 = Ni2+ + C2O42- K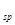 (NiC2O4)=4.0×10-10 ,
(NiC2O4)=4.0×10-10 ,
由所求方程式可由②—①得,因此该式的平衡常数K=K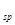 (NiC2O4)/ K
(NiC2O4)/ K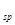 (Ni(OH)
(Ni(OH)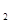 )= 8.0×105L.mol-1 。
)= 8.0×105L.mol-1 。
(5)过滤1后的滤液是氯化钠溶液,因此电解氯化钠溶液能得到氧化性的气体氯气。洗涤Ni(OH)3 沉淀的操作是:往盛有Ni(OH)3 沉淀的漏斗中注入蒸馏水至浸没沉淀,待水自然流干后,再重复2~3次。
考点:本题考查的是简单的化学工艺流程题,考查的操作较多。
本题难度:困难
2、选择题 已知Ksp(AgCl)>Ksp(AgI),将AgCl和AgI的饱和溶液等体积混合,再加入足量浓AgNO3溶液,发生的反应为( )
A.只有AgI沉淀生成
B.AgCl和AgI沉淀等量生成
C.AgCl和AgI沉淀都有,但以AgCl沉淀为主
D.AgCl和AgI沉淀都有,但以AgI沉淀为主
参考答案:在AgCl和AgI两饱和溶液中,前者c(Ag+)大于后者c(
本题解析:
本题难度:简单
3、选择题 在溶液中有浓度均为0.01mol/L的Fe3+、Cr3+、Zn2+、Mg2+等离子,已知:Ksp[Fe(OH)3]=2.6×10-39; Ksp[Cr(OH)3] =7.0×10-31 Ksp[Zn(OH)2] =1.0×10-17; Ksp[Mg(OH)2] =1.8×10-11当氢氧化物开始沉淀时,下列哪一种离子所需溶液的pH最小[???? ]
A.Fe3+
B.Cr3+
C.Zn2+
D.Mg2+
参考答案:A
本题解析:
本题难度:一般
4、选择题 已知CuSO4溶液分别与Na2CO3、Na2S溶液的反应情况如下: ? 据此判断,下列几种物质KSP大小的比较中正确的是?????
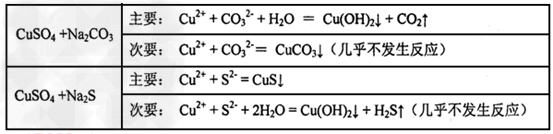 [???? ]
[???? ]
A.Cu(OH)2<CuS<CuCO3?????????
B.CuS<Cu(OH)2<CuCO3 ????
C.CuCO3<Cu(OH)2<CuS?????????
D.CuCO3<CuS<Cu(OH)2
参考答案:B
本题解析:
本题难度:一般
5、选择题 已知25 。C时,AgI饱和溶液中c(Ag+)为1.22×10-8 mol/L,AgCl的饱和溶液中c(Ag+)为 1.25×10-5 mol/L。若在5 mL含有KCl和KI各为0.01 mol/L的溶液中,加入8 mL 0.01 mol/L AgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确的是[???? ]
A.c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-)
B.c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-)
C.c(NO3-)>c(K+)>c(Ag+)>c(Cl-)>c(I-)
D.c(K+)>c(NO3-)>c(Ag+)=c(Cl-)+c(I-)
参考答案:A
本题解析:
本题难度:一般