微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 根据以下叙述制备氯化铜:先将浓盐酸用蒸气加热至80℃左右,慢慢加入含有FeO杂质的CuO粉,充分反应,使其溶解.已知:FeS不溶于水,但溶于酸;在除去溶液中的Fe2+时,可采用的方法是( )
| 溶液中被沉淀离子 | Fe3+ | Fe2+ | Cu2+
完全生成氢氧化物沉淀时,溶液的pH
≥3.7
≥9.6
≥6.4
A.可直接加碱,调整溶液的pH≥9.6
B.加入纯铜粉,将Fe2+还原为Fe
C.先将Fe2+氧化成Fe3+,再调整溶液pH至3~4
D.通入H2S使Fe2+直接沉淀
2、填空题 (14分)孔雀石主要含Cu2(OH)2CO3,还含少量铁的化合物和硅的化合物。以孔雀石为原料可制备CuCl2·3H2O及纯碱,流程如下图。

且知:溶液A只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀的pH如下表所示。回答下列问题:
金属离子
| Fe3+
| Fe2+
| Cu2+
| PH
| 氢氧化物开始沉淀
| 1.9
| 7.0
| 4.7
| 氢氧化物完全沉淀
| 3.2
| 9.0
| 6.7
(1)孔雀石研磨的目的是 。
(2)孔雀石的主要成分与足量稀硫酸反应的化学方程式为 。
(3)使用上图中“试剂1”的目的是将溶液中的Fe2+转化为Fe3+,试剂B宜选用 (填选项序号)。
A.酸性KMnO4溶液 B.双氧水 C.浓硝酸 D.氯水
(4)加入CuO作用是调节溶液pH,使Fe3+转化为沉淀予以分离。则pH的范围为 。
(5)气体E、F与饱和食盐水作用生成H和G时,E和F应按一定先后顺序通入饱和食盐水中,其中,应先通入气体是 (填代号及对应物质的化学式)。
(6)由溶液C获得CuCl2·3H2O,需要经过 、 、过滤等操作。
(7)已知:常温下Cu(OH)2的Ksp=2×10-20。计算Cu2++2H2O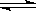 Cu(OH)2+2H+反应平衡常数 。 Cu(OH)2+2H+反应平衡常数 。
3、简答题 工业上制氯化铜无水物时,是将浓盐酸用蒸气加热至80℃左右,慢慢加入粗制氧化铜粉(含杂质氧化亚铁和SiO2),充分搅拌后使之溶解,制取流程如下:
已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;常温时Ksp[Fe(OH)3]=c(Fe3+).c3(OH-)=1.0×10-38.试回答:
(1)根据常温时Fe(OH)3的Ksp计算,当溶液中的Fe3+完全沉淀(此时溶液中的Fe3+物质的量的浓度=10-5mol/L),溶液的pH=______.
(2)溶液D制取无水CuCl2时,需在HCl气体中蒸干,原因是______.
(3)粗CuO溶于过量盐酸后,得到的溶液B中加入试剂x将Fe2+氧化为Fe3+,试剂x可以是______(填以下选项序号).
A.KMnO4溶液????B.氯水????C.NaClO溶液????D.O3
若用H2O2溶液,则反应的离子方程式为______.
(4)溶液C加入试剂y,要调整溶液的pH至3-4,试剂y不能是______(填以下选项序号),原因是______.
A.NaOH溶液????B.Cu(OH)2固体????C.Cu2(OH)2CO3固体????D.CuO固体
(5)将ag粗CuO经过以上一系列操作之后,最终得到bg无水CuCl2(不考虑实验过程中操作引起的损耗),下列说法正确的是______.(NA表示阿伏伽德罗常数)
A.粗CuO中Cu2+数目小于 aNA
80
????????B.粗CuO中CuO物质的量小于?b
135
?mol
C.粗CuO中所含的铜元素的质量分数为64b
135a
?x100%
D.粗CuO中关于CuO的量无法确定.
4、填空题 下图是某研究性学习小组设计的对一种废旧合金的各成分(含有Cu、Fe、Si 三种成分)进行分离、回收再利用的工业流程,通过该流程将各成分转化为常用的单质及化合物。
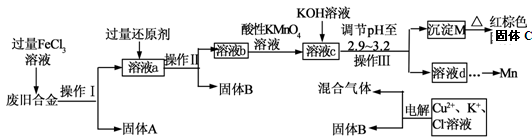
已知:298K时,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38, Ksp[Mn(OH)2] =1.9×10-13,
根据上面流程回答有关问题:
(1)操作Ⅰ、Ⅱ、Ⅲ指的是?????????????????????????????????????。
(2)加入过量FeCl3溶液过程中可能涉及的化学方程式:????????????????????。
(3)过量的还原剂应是????????????????????????????????????????????????????????。
(4)①向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为?????????????????????。
②若用X mol/L KMnO4溶液处理溶液b,当恰好将溶液中的阳离子完全氧化时消耗KMnO4溶液YmL,则最后所得红棕色固体C的质量为?????????????????g(用含X、Y的代数式表示)。
(5)常温下,若溶液c中所含的金属阳离子浓度相等,向溶液c中逐滴加入KOH溶液,则三种金属阳离子沉淀的先后顺序为:?????????????﹥???????????﹥????????????。(填金属阳离子)
(6)最后一步电解若用惰性电极电解一段时间后,析出固体B的质量为Z g,同时测得阴阳两极收集到的气体体积相等,则标况下阳极生成的最后一种气体体积为?????L(用含Z的代数式表示);该电极的反应式为???????????????????????????????????????????????????????????? .
5、填空题 (8分)工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法l:还原沉淀法?
该法的工艺流程为??

其中第①步存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显????色。
(2)能说明第①步反应达平衡状态的是??????????。
a.Cr2O72-和CrO42-的浓度相同
b.2v(Cr2O72-)=v(CrO42-)
c.溶液的颜色不变
(3)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)?Cr3+(aq)+3OH-(aq)??
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)?c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至??????????。
方法2:电解法
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。?
(4)用Fe做电极的原因为????????????????????????????????。
(5)在阴极附近溶液pH升高的原因是(用电极反应解释) ???????????????????????????。
溶液中同时生成的沉淀还有???????????????????????。
|
|
|
网站客服QQ: 960335752 - 14613519 - 791315772
|
|