微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在含有Cu(NO3)2、Fe(NO3)3、AgNO3各0.1 mol的混合溶液中加入铁粉,经反应未见气体放出,析出3.2 g铜时,溶解的铁粉的质量是(???)
A.5.6 g
B.2.8 g
C.14 g
D.8.4 g
2、实验题 (12分)某同学欲在实验室中完成Fe与水蒸气反应的实验,装置如图甲、乙两种。
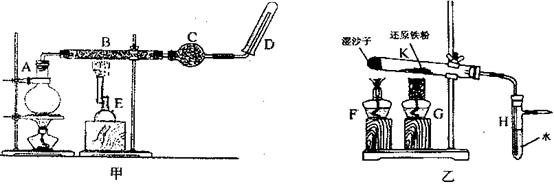
已知B中放入的是铁与石棉绒的混合物,C中放的是干燥剂,E为酒精喷灯,G为带有铁丝网罩的酒精灯。
Ⅰ.对比两装置,回答下列问题:
(1)如何检查乙装置的气密性??????????????????????????????????????。
(2)乙装置中湿沙子的作用是????????????????????????????????????????。
(3)B处发生反应的化学方程式:??????????????????????????????????????????。
(4)该同学认为欲在乙 装置的尖嘴导管处点燃反应产生的气体,装置H必不可少,H的作用是??????????????????????????????????????。
装置的尖嘴导管处点燃反应产生的气体,装置H必不可少,H的作用是??????????????????????????????????????。
(5)对比甲、乙两装置的B和K,B的优点是??????????????????????????????。
Ⅱ.某同学为了研究一定时间内铁粉的转化率,用上图中的甲装置设计了如下实验:准确称量一定质量的铁粉进行反应,收集并测量反应后生成的气体体积,计算铁粉的转化率。
①用排水法收集并测量气体体积可选下图中的?????????????????装置。
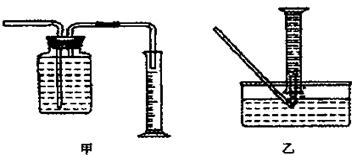
②称取mg铁粉与适量石棉绒混合,然后加热至无气体放出。若收集的气体体积换算为标准状况为VL,铁粉的转化率为(列出计算式即可)????????????????????????。
③为了证明反应后的固体混合物中含有+3价的Fe,该同学取出少量混合物于试管中,加入足量的盐酸,溶解后过滤,立即向溶液中滴加KSCN溶液,结果观察到溶液的颜色没变化。经过思考,该同学认为此现象不能说明反应后的固体混合物中不含有+3价Fe。他的理由是:????????????????????????。
3、填空题 铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)FeCl3溶液用作蚀刻铜箔制造电路板的工艺,离子方程式为 ?????????
(2)现有一含有FeCl2和FeCl3的混合样品,测得n(Fe): n(Cl)=1:2.1,则该样品中FeCl3的物质的量分数为___???? _。证明混合物中存在Fe2+的操作:????????????????????,在实验室中,FeCl3可用铁粉和___???____反应制备.
(3)有学生利用FeCl3溶液制取FeCl3·6H2O晶体主要操作包括:滴入过量盐酸,?????????、冷却结晶、过滤。过滤中要用到的玻璃仪器有漏斗、烧杯和???????????。
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为___?????????????????????。
4、填空题 (13分)材料1:铁及其化合物在工农业、生活中有广泛的应用。高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。
(1)已知:4FeO42-+10H2O 4Fe(OH)3+8OH-+3O2。
4Fe(OH)3+8OH-+3O2。
K2FeO4在处理水的过程中所起的作用有????????????????????????????????????。
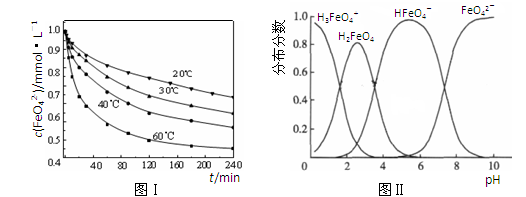
(2)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-) =1.0 mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅰ。该实验的目的是????????????????????????????????????????????????;发生反应的△H???????0(填“>”、“<”或“=”)。
(3)FeO42-在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是????????(填字母)。
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数逐渐增大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:
HFeO4-+OH-=FeO42-+H2O
材料2:化合物KxFe(C2O4) y·zH2O(Fe为+3价)是一种光敏感材料,实验室可以用如下方法制备这种材料并测定其组成。
I.制备:

(4)结晶时应将饱和溶液在黑暗处等待晶体的析出,这样操作的原因是????????????????????????????????????????????????????????。
(5)操作Ⅲ的名称是????????????????????????????????????。
Ⅱ.组成测定:
称取0.491g实验所得晶体(假设是纯净物)置于锥形瓶中,加足量蒸馏水和稀H2SO4。将C2O42-完全转化为H2C2O4,用0.10mol·L-1KMnO4溶液进行滴定,消耗KMnO4溶液12.00mL时恰好反应;再加入适量的还原剂,将Fe3+完全转化为Fe2+,用KMnO4溶液继续滴定,当Fe2+完全氧化时,用去KMnO4溶液2.00mL。相关反应如下:
2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
(6)配制250mL 0.10mol·L-1KMnO4溶液及上述滴定实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、锥形瓶外还有????????????????和????????????????。两个滴定中到达终点时溶液颜色为???????????色,且30秒内不变色。
(7)通过计算,求此光敏材料的化学式??????????????????????????????。
5、选择题 使a g Fe粉与一定量的硝酸溶液充分反应(Fe粉完全溶解),生成的气体与标准状况下b L O2混合后,恰好能被水完全吸收,a和b的关系可能是
A.b >0.3a
B.b <0.2a
C.0.2a<b <0.3a
D.无法确定