微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各组离子,在水溶液中能大量共存的是
A.Na+、Cu2+、SO42-、OH-
B.Na+、K+、HCO3-、NO3-
C.Mg2+、H+、CO32-、NO3-
D.H+、Na+、ClO-、Cl-
参考答案:B
本题解析:分析:根据离子之间不能结合生成水、气体、沉淀、弱电解质等,则离子能大量共存,以此来解答.
解答:A.因Cu2+、OH-能结合生成沉淀,则不能共存,故A错误;
B.因该组离子之间不反应,则能够共存,故B正确;
C.因H+、CO32-反应生成水和气体,则不能共存,故C错误;
D.因H+、ClO-能结合生成弱电解质HClO,则不能共存,故D错误;
故选B.
点评:本题考查离子的共存,明确复分解反应发生的条件及常见离子之间的反应即可解答,题目较简单.
本题难度:简单
2、选择题 pH相同的氨水、NaOH和Ba(OH)2溶液,分别用蒸馏水稀释到原来的X、Y、Z倍,稀释后三种溶液的pH仍然相同,则X、Y、Z的关系是
A.X=Y=Z
B.X>Y=Z
C.X<Y=Z
D.X=Y<Z
参考答案:B
本题解析:
试题分析:氨水是弱电解质、氢氧化钡和氢氧化钠是强电解质。在稀释过程中,会促进氨水的电离,所以要使稀释后的pH熔融相等,则氨水稀释的倍数要大于强电解质的,即.X>Y=Z,答案选B。
考点:考查弱电解质的电离以及pH的计算
点评:弱电解质在溶液中存在电离平衡,所以稀释会促进电离,是离子的物质的量增加,但浓度是降低的,而强电解质不存在电离平衡,离子的浓度是成倍减小的,据此可以进行有关的判断。
本题难度:简单
3、选择题 常温下,用0.1000mol·L-1NaOH溶液滴定20.00mL 0.1000mol·L-1CH3COOH溶液,滴定曲线如右图。下列说法正确的是
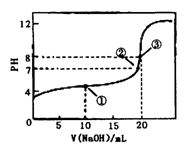
A.点①所示溶液中:[CH3COO-]+[OH-]=[CH3COOH] +[H+]
B.点②所示溶液中:[Na+]=[CH3COOH]+[CH3COO-]
C.点③所示溶液中:[Na+]>[OH-]>[CH3COO-]>[H+]
D.滴定过程中可能出现:[CH3COOH]>[CH3COO-]>[H+]>[Na+」>[OH-]
参考答案:D
本题解析:A 错误,应遵循电荷守恒,[CH3COO-]+[OH-]=[Na+]+[H+]
B 错误,点②所示溶液PH=7,显中性,[Na+]=[CH3COO-]
C 错误,点③所示溶液中:[Na+]>[CH3COO-]>[OH-]>[H+]
D 正确。在CH3COOH溶液中开始滴入很少量的NaOH溶液时出现此种情况。
本题难度:简单
4、选择题 300 mL某浓度的NaOH溶液中含有60 g溶质。现欲配制1 mol /L NaOH溶液,应取原溶液与蒸馏水的体积比约为
A.1∶4
B.1∶5
C.2∶1
D.2∶3
参考答案:A
本题解析:试题分析:依据题意可知即需要NaOH的质量m=n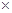 M=c
M=c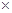 V
V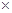 M=1
M=1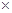 1
1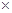 40g=40g,所以需要200mL(300/60
40g=40g,所以需要200mL(300/60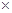 40 mL="200" mL),即还需要蒸馏水800 mL,即200:800=1∶4
40 mL="200" mL),即还需要蒸馏水800 mL,即200:800=1∶4
考点:考查物质的量浓度的相关计算
点评:该题是基础性试题的考查,属于高考中的常见考点之一,难度不大。
本题难度:一般
5、选择题 钠跟镁一样能跟某些氧化物反应夺取其中的氧,当钠失火时能用来灭火的是
A.水
B.二氧化碳
C.沙土
D.泡沫灭火器
参考答案:C
本题解析:钠极易和水反应生产氢气,同时钠的燃烧产物过氧化钠也可以和水反应生成氧气,A不正确。同样钠的燃烧产物过氧化钠还可以和二氧化碳反应生成氧气,所以B、D不正确。沙土中含有二氧化硅,与钠及钠的燃烧产物不反应,C正确。
本题难度:困难