微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将0.1mol下列物质置于1L水中充分搅拌后,溶液中阴离子数最多的是
A.KCl
B.Mg(OH)2
C.Na2CO3
D.MgSO4
参考答案:C
本题解析:分析:根据盐类的水解和物质的溶解度思考.
解答:对于A和D,由于KCl和MgSO4溶于水并完全电离,所以n(Cl-)=n(SO42-)=0.1mol l(水电离出的OH-可忽略);对于B,B中的Mg(OH)2在水中难溶,故溶液中n(OH-)<0.1mol;对于C,在Na2CO3溶液中,由于CO32-+H2O?HCO3-+OH-,阴离子数目会增加,即阴离子物质的量大于0.1mol.由上分析,Na2CO3溶液中的阴离子数目最多,C项正确.
故答案为C.
点评:二元酸正盐阴离子水解会使溶液中的阴离子数目增多,可以作为一个解题规律来应用.
本题难度:一般
2、选择题 下列微粒中,只具有氧化性的是
A.S
B.Na
C.Fe2+
D.Cu2+
参考答案:D
本题解析:分析:根据元素化合价的高低判断微粒的氧化性、还原性,最高价态的只有氧化性,最低价态的只有还原性,中间价态的既有氧化性又有还原性.
解答:A、硫元素的化合价处于中间价态,所以有氧化性和还原性,故A错误;
B、金属钠的化合价处于最低价态,所以有还原性,故B错误;
C、Fe2+的化合价处于中间价态,所以既有氧化性又有还原性,故C错误;
D、Cu2+的化合价处于最高价态,所以只有氧化性,故D正确;
故选D.
点评:本题考查了氧化还原反应的概念应用,判断微粒氧化性还原性的规律是:最高价态的只有氧化性,最低价态的只有还原性,中间价态的既有氧化性又有还原性.
本题难度:一般
3、选择题 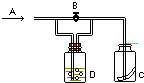 如图所示,A处通入Cl2,关闭B阀时,C处红色布条无变化;?打开B阀时,C处红色布条褪色,则D中的溶液是
如图所示,A处通入Cl2,关闭B阀时,C处红色布条无变化;?打开B阀时,C处红色布条褪色,则D中的溶液是
A.浓H2SO4
B.H2O
C.NaOH溶液
D.饱和食盐水
参考答案:AC
本题解析:分析:依据题干信息和发生的现象分析,干燥的氯气不能漂白有色布条,湿润的氯气能使有色布条褪色;
解答:A处通入Cl2,关闭B阀时,C处红色布条无变化;??打开B阀时,C处红色布条褪色,说明D装置的作用起到干燥氯气的作用,或吸收氯气,选项中的物质能干燥氯气的只有浓硫酸;能吸收氯气的是氢氧化钠溶液;
故选AC.
点评:本题考查了氯气的化学性质,干燥气体的试剂选择,装置图的理解和分析,注意氢氧化钠的吸收作用.
本题难度:一般
4、选择题 将过氧化钠和碳酸氢钠固体均匀混合后,在密闭容器中加热至120℃,维持该温度至反应完全,趁热排出气体物质后冷却,残留的固体物质的成分不可能是
A.Na2CO3
B.Na2O2、Na2CO3
C.NaOH、Na2CO3
D.Na2O2、NaOH、Na2CO3
参考答案:B
本题解析:分析:容器中碳酸氢钠分解先进行,但生成的水与过氧化钠反应产生的氢氧化钠又要和二氧化碳反应,只有当容器中的二氧化碳消耗完毕了才会有氢氧化钠存在.
解答:该题涉及的化学方程式有:①2NaHCO3 Na2CO3+H2O+CO2↑,②2CO2+2Na2O2═Na2CO3+O2↑,③2H2O+2Na2O2═4NaOH+O2↑,④2NaOH+CO2═Na2CO3+H2O,
Na2CO3+H2O+CO2↑,②2CO2+2Na2O2═Na2CO3+O2↑,③2H2O+2Na2O2═4NaOH+O2↑,④2NaOH+CO2═Na2CO3+H2O,
当过氧化钠不足,②反应没有完全,容器中的固体成分为碳酸钠;
当②反应恰好完全,③反应未进行时,容器中的固体成分仍为碳酸钠;
当②反应完全③未反应完全时,容器中的固体成分为碳酸钠和氢氧化钠;
当③反应完全时,容器中的固体成分仍为碳酸钠和氢氧化钠;
当③反应完全,过氧化钠有剩余时,容器中的固体成分为碳酸钠、氢氧化钠和过氧化钠.
故选B.
点评:本题主要考查学生哪的化合物的性质,综合性很强,难度很大,要求学生具有分析和解决问题的能力.
本题难度:一般
5、选择题 在2H2S+SO2=2H2O+3S中,氧化剂与还原剂的分子个数比为
A.2:1
B.1:2
C.1:1
D.16:17
参考答案:B
本题解析:分析:由反应2H2S+SO2═3S+2H2O可知,H2S中S元素化合价由-2价升高为0价,H2S是还原剂,SO2中S元素化合价由+4价降低为0价,SO2是氧化剂.根据反应中化合价发生变化的S原子数目结合N=nNA计算判断氧化剂和还原剂的分子个数比.
解答:反应2H2S+SO2═3S+2H2O中,H2S中S元素化合价由-2价升高为0价,H2S是还原剂;SO2中S元素化合价由+4价降低为0价,SO2是氧化剂.根据反应中化合价发生变化的S原子数目可知参加反应的H2S全部为还原剂,参加反应的SO2全部为还原剂,所以氧化剂与还原剂的物质的量之比等于化学计量数之比为1:2,根据N=nNA知,氧化剂和还原剂的分子个数之比等于其物质的量之比=1:2,故选B.
点评:考查氧化还原反应的计算、氧化还原反应基本概念,难度不大,关键根据化合价判断氧化剂与还原剂.
本题难度:一般