微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 三氟化氮(NF3)是微电子工业中一种优良的等离子蚀刻气体。它无色、无臭,在潮湿的空气中能发生下列反应:3NF3+5H2O 2NO+HNO3+9HF,下列有关说法正确的是( )
2NO+HNO3+9HF,下列有关说法正确的是( )
A.反应中NF3是氧化剂,H2O是还原剂
B.反应中被氧化与被还原的原子物质的量之比为2∶1
C.若反应中生成0.2 mol HNO3,则反应共转移0.2 mol e-
D.NF3在潮湿的空气中泄漏会产生白雾、红棕色气体等现象
参考答案:D
本题解析:NF3中N是+3价,F是-1价,HNO3中N是+5价,故此反应是歧化反应,被氧化与被还原的原子都是N,画出双线桥,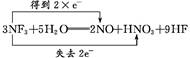 就可以得出反应中NF3既是氧化剂又是还原剂,H2O既不是氧化剂也不是还原剂;反应中被氧化与被还原的原子物质的量之比为1∶2;若反应中生成0.2 mol HNO3,则反应共转移0.4 mol e-,由
就可以得出反应中NF3既是氧化剂又是还原剂,H2O既不是氧化剂也不是还原剂;反应中被氧化与被还原的原子物质的量之比为1∶2;若反应中生成0.2 mol HNO3,则反应共转移0.4 mol e-,由
本题难度:一般
2、填空题 随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金维生素”。已知钒的原子序数为23,回答下列问题:
(1)钒被认为是一种稀土元素,广泛分散于各种矿物中。钾钒铀矿中的钒原子最外层已达8电子稳定结构,其化学式为K2H6U2V2O15,若用氧化物的形式表示,该化合物的化学式为_______________________。
(2)测定钒含量的方法是先把钒转化成V2O5,V2O5在酸性溶液里转变成VO2+,再用盐酸、硫酸亚铁、草酸等测定钒。总反应式可表示为:
VO2++H2C2O4→VO++CO2+H2O(未配平)
其中还原剂是_______。若消耗0.9 g草酸,所对应钒元素质量是_______g。
参考答案:⑴K2O·2UO3·V2O5·3H2O。?⑵H2C2O4??
本题解析:(1)要用氧化物形式表示该化合物的 化学式,必须先确定钒、铀的化合价。由于钾元素必定显+1价,根据“钒原子最外层已达8电子稳定结构”,可推出钒应失去5个电子变成氩原子结构,所以钒元素显+5价。再根据化合价规律可计算出铀的化合价应是+6。
(2)将题给反应式配平可得:VO2++H2C2O4= VO++2CO2↑+H2O。根据配平后的方程式计算可得到钒元素的质量数值。
本题难度:一般
3、选择题 b g某金属与足量的稀硫酸反应,生成该金属的三价正盐和a g氢气。该金属的相对原子质量为
A.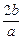
B.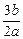
C.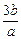
D.
参考答案:C
本题解析:本题考查的知识点是氧化还原反应的计算。依据在氧化还原反应中氧化剂得电子数与还原剂失电子数相等。可得: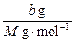 ×3=
×3=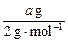 ×2?得
×2?得
本题难度:简单
4、选择题 下列说法正确的是( )
A.常温常压下,22.4 L氯气与足量镁粉充分反应,转移的电子数为2NA
B.化合反应均为氧化还原反应
C.电解NaCl溶液得到22.4 L H2(标准状况),理论上需要转移NA个电子(NA表示阿伏加德罗常数)
D.易燃试剂与强氧化性试剂分开放置并远离火源
参考答案:D
本题解析:A项,常温常压下22.4 L Cl2不是1 mol,与Mg反应转移的电子数也不是2NA;B项,化合反应不一定全是氧化还原反应;C项,n(H2)=22.4/22.4=1 mol
故n(e-)=1 mol×2=2 mol
即N(e-)=2NA;D项,易燃试剂往往具有强的还原性,遇到强氧化剂时易燃烧。
本题难度:一般
5、填空题 (6分)处理含CN-(其中C为+ 2价)的工业废水常用Cl0_氧化,生成的CNO (其中C为+4价),反应的离子方程式为: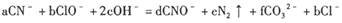
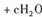 ,上述离子方程式可能的配平系数有多组。请回答:
,上述离子方程式可能的配平系数有多组。请回答:
(1)??该离子方程式中e:f的值是________(填选项标号)。
A.0.5
B.1
C.2
D.不能确定
(2)??若d="e" =l,则b=________
(3)若反应中转移1.2mol电子,则生成的气体在标况的体积是________。
参考答案:(1)A?(2)6???(3)2.24L
本题解析:(1)由C原子守恒知:a=d+f???由N原子守恒知:a=d+2e
故f=2e,即e:f=1/2=0.5
(2)若d="e" =l,由a=d+2e知,a=3,再由a=d+f知,f=2
由化合价的升降守恒知:2b=2d+6e+2f,知b=6
(3)当有1mol氮气生成时,转移的电子为12mol,故若反应中转移1.2mol电子,则生成的气体在标况的体积是0.1×22.4=2.24L
本题难度:一般