微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”.已知钒的原子序数为23,相对原子质量为51,试回答下列问题:
(1)钒在元素周期表位于第______周期,第______族.
(2)钒被认为是一种稀土元素,广泛分散于各种矿物中,钾钒铀矿中的化学式为K2H6U2V2O15(其中钒元素的化合价为+5价).若用氧化物的形式表示,该化合物的化学式为______.
(3)测定钒含量的方法是先把钒转化成V2O5,V2O5在酸性溶液里转变成VO2+,再用盐酸、硫酸亚铁、草酸等测定钒.请配平下列反应的化学方程式:______VO2++______H2C2O4→______VO++______CO2+______H2O其中还原剂是______;若反应消耗0.90g草酸,参加反应的钒元素质量是______g.
(4)工业上由V2O5冶炼金属钒常用铝热剂法.试用化学方程式表示出来______.
2、选择题 a mol FeS与b mol FeO投入到V L、c mol·L-1的稀硝酸溶液中充分反应,产生NO气体,所得澄清溶液的成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为( )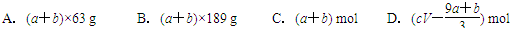
3、选择题 一定物质的量的Cl2与NaOH溶液反应,所得产物中含NaClO和NaClO3的物质的量之比为3:5,则参加反应的Cl2与NaOH的物质的量之比为(??????)
A.8:11
B.3:5
C.1:2
D.9:4
4、计算题 在900℃的空气中合成出一种含镧、钙和锰 (摩尔比2 : 2 : 1) 的复合氧化物,其中锰可能以 +2、+3、+4 或者混合价态存在。为确定该复合氧化物的化学式,进行如下分析:
⑴ 准确移取25.00 mL 0.05301 mol·L-1的草酸钠水溶液,放入锥形瓶中,加入25 mL蒸馏水和5 mL 6 mol·L-1的HNO3溶液,微热至60~70oC,用KMnO4溶液滴定,消耗27.75 mL。写出滴定过程发生的反应的方程式;计算KMnO4溶液的浓度。
⑵ 准确称取0.4460 g复合氧化物样品,放入锥形瓶中,加25.00 mL上述草酸钠溶液和30 mL 6 mol·L-1的HNO3溶液,在60~70oC下充分摇动,约半小时后得到无色透明溶液。用上述KMnO4溶液滴定,消耗10.02 mL。根据实验结果推算复合氧化物中锰的价态,给出该复合氧化物的化学式,写出样品溶解过程的反应方程式。已知La的原子量为138.9。
5、简答题 钾是活泼的碱金属,钾和氧有氧化钾(K2O)、过氧化钾(K2O2)和超氧化钾(KO2)等多种化合物.
(1)钾和硝酸钾反应可制得氧化钾:K+KNO3→K2O+N2(未配平),每生成9.4gK2O消耗的还原剂有______g;
(2)超氧化钾和过氧化钾都能与二氧化碳反应均生成氧气和K2CO3,在医院、矿井、潜水、高空飞行中用作供氧剂.写出超氧化钾与二氧化碳反应的化学方程式______,为了维持气压稳定,可以使用超氧化钾和过氧化钾的混合物使吸收的CO2与生成的O2体积相同(同温同压),则它们的物质的量之比为n(KO2):n(K2O2)=______;
(3)KO2加热至600℃部分分解得到产物A.6.30g产物A充分吸收二氧化碳生成碳酸钾并产生氧气1.12L(标准状况),试确定产物A中钾氧两种原子个数之比.______如果产物A只含有两种化合物,写出所有可能的化学式并计算A中两种化合物的物质的量之比.______.