微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 Ⅰ.在一体积为10 L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0,CO和H2O浓度变化如图所示:
CO2(g)+H2(g) ΔH<0,CO和H2O浓度变化如图所示:
(1)0~4 min的平均反应速率v(CO)=________mol/(L·min),反应在第5 min时的平衡常数K=________。

t℃时物质浓度(mol/L)的变化
时间(min)
| CO
| H2O
| CO2
| H2
|
0
| 0. 200
| 0. 300
| 0
| 0
|
2
| 0. 138
| 0.238
| 0.062
| 0.062
|
3
| c1
| c2
| c3
| c3
|
4
| c1
| c2
| c3
| c3
|
5
| 0. 116
| 0. 216
| 0. 084
| ?
|
6
| 0. 096
| 0. 266
| 0. 104
| ?
?
(2)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表所示:
①表中3~4 min之间反应处于________状态;c1数值________(填“>”“=”或“<”)0.08 mol/L。
②反应在4~5 min间,平衡向逆反应方向移动,可能的原因是________(填标号,下同),表中5~6 min之间数值发生变化,可能的原因是________。
A.增加水蒸气B.降低温度C.使用催化剂D.增加氢气浓度
Ⅱ.在热的稀硫酸中溶解了11.4 g硫酸亚铁固体,当加入50 mL 0.5 mol/L的KNO3溶液后,使其中的Fe2+全部转化成Fe3+、KNO3也完全反应并放出NxOy气体。
(3)推算出x=________,y=________。
(4)写出该反应的化学方程式:________________(x、y用具体数值表示)。
(5)反应中氧化产物是________。
2、选择题 Na2FeO4是一种新型水处理剂,可以通过下列反应制取:
□NaClO + □Fe2(SO4)3 + □ M ?="=" □Na2FeO4+ □NaCl + □H2O + □ N?
下列有关该反应的说法错误的是
A.Na2FeO4是氧化产物,有强氧化性,可消毒杀菌,其还原产物能吸附水中杂质
B.氧化剂与还原剂的物质的量之比为3∶1
C.M与N分别是NaOH和H2SO4
D.若有3 mol NaClO完全反应,则生成2 mol Na2FeO4
3、选择题 我国的新(饮用天然矿泉水国家标准)规定了饮用水中可能致癌物溴酸盐的限值:0.01mg/L,日前很多饮用水企业都采用臭氧消毒法进行水的消毒,这个过程可能生成溴酸盐。原因是水中的Br-被臭氧氧化为BrO2-,其过程示意为:Br- BrO- BrO- BrO2- BrO2- BrO3-,下列有关说法正确的是 BrO3-,下列有关说法正确的是
A.臭氧消毒法和明矾净水原理相同,都是利用胶体吸附原理
B.若改用氧气消毒,可避免生成溴酸盐
C.BrO- 3氧化性比O3强
D.生成溴酸盐的过程是给水消毒的副反应,需控制条件减少BrO3-的产生
4、填空题 磷单质及其化合物在工业生产中有着广泛的应用。白磷可用于制备高纯度的磷酸(磷酸结构式为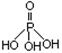 ),三聚磷酸钠(俗称“五钠”)是常用的水处理剂,次磷酸钠(NaH2PO2)可用于化学镀镍等等。 ),三聚磷酸钠(俗称“五钠”)是常用的水处理剂,次磷酸钠(NaH2PO2)可用于化学镀镍等等。
完成下列填空:
(1)磷元素原子核外最外层电子排布式为???????????。NaH2PO2中涉及到四种元素,它们的原子半径由小到大的顺序为???????????。
(2)氧原子核外有?????种不同能量的电子。
(3)写出与磷同周期的主族元素中,离子半径最小的元素,其最高价氧化物对应水化物的电离方程式????????????????????????????????????????????????????????????。
(4)磷酸二氢钠主要用于制革、处理锅炉水及在食品工业、发酵工业中作缓冲剂。其水溶液呈酸性的原因是_______________________________________________________。
(5)三聚磷酸可视为三个磷酸分子之间脱去两个水分子的产物,其结构式为???????????。三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为____________。
(6)次磷酸钠(NaH2PO2)可用于化学镀镍。化学镀镍的溶液中含有Ni2+和H2PO2-,在一定条件下能发生如下反应:__Ni2++__H2PO2-+????→__Ni + ___H2PO3-+ ????。请完成并配平上述反应离子方程式。该反应的还原产物是__________。
5、选择题 将一定量的氯气通入30 mL浓度为10.00 mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是
A.与NaOH反应的氯气一定为0.3 mol
B.n(Na+)∶n(Cl-)可能为7∶3
C.若反应中转移的电子为n mol,则0.15 < n < 0.25
D.n(NaCl)∶n(NaClO)∶n(NaClO3)可能为11:2:1
|