微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关说法正确的是
A.CaCO3(s) =CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0
B.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈
C.N2(g)+3H2(g) =2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2 )和H2的平衡转化率均增大
D.水的离子积常数Kw 随着温度的升高而增大,说明水的电离是放热反应
2、选择题 有一反应:2A+B 2C,其中A、B、C均为气体,下图中的曲线是该反应在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有 a、b、c三点,如图所示,则下列描述正确的是(??)
2C,其中A、B、C均为气体,下图中的曲线是该反应在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有 a、b、c三点,如图所示,则下列描述正确的是(??)
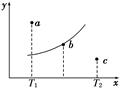
A.该反应是放热反应
B.b点时混合气体的平均摩尔质量不再变化
C.T1温度下若由a点达到平衡,可以采取增大压强的方法
D.c点:v(正)<v(逆)
3、选择题 2.0 mol PCl3和1.0 mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g) PCl5(g)达平衡时,PCl5为0.40 mol,如果此时移走1.0 mol PCl3和0.50 mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( ??)
PCl5(g)达平衡时,PCl5为0.40 mol,如果此时移走1.0 mol PCl3和0.50 mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( ??)
A.0.40 mol
B.0.20 mol
C.小于0.20 mol
D.大于0.20 mol,小于0.40 mol
4、填空题 (14分)二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
(1)利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) + CO(g)  ?CH3OH(g);ΔH =-90.8 kJ·mol-1
?CH3OH(g);ΔH =-90.8 kJ·mol-1
② 2CH3OH(g)  ?CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
?CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
③ CO(g) + H2O(g)  ?CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
?CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
总反应:3H2(g) + 3CO(g)  ?CH3OCH3(g) + CO2 (g)的ΔH= ___________;
?CH3OCH3(g) + CO2 (g)的ΔH= ___________;
(2)已知反应②2CH3OH(g)  ?CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
?CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下: