微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 海底蕴藏着大量的“可燃冰”。用甲烷制水煤气(CO、H2),再合成甲醇来代替日益供应紧张的燃油。
已知:
① CH4(g)+H2O (g)=CO (g)+3H2(g)???? △H1=+206.2kJ·mol-1
② CH4(g)+O2(g)=CO(g)+2H2(g)??????? △H2=-35.4 kJ·mol-1
③ CH4 (g)+2H2O (g)=CO2 (g)+4H2(g)?? △H3=+165.0 kJ·mol-1
(1)CH4(g)与CO2 (g)反应生成CO(g)和H2(g)的热化学方程式为???????????。
(2)从原料、能源利用的角度,分析反应②作为合成甲醇更适宜方法的原因是 ???????????????????????????。
(3)水煤气中的H2可用于生产NH3,在进入合成塔前常用[Cu(NH3)2]Ac溶液来吸收其中的CO,防止合成塔中的催化剂中毒,其反应是:
[Cu(NH3)2]Ac + CO + NH3 ?[Cu(NH3)3]Ac·CO??? △H<0
?[Cu(NH3)3]Ac·CO??? △H<0
[Cu(NH3)2]Ac溶液吸收CO的适宜生产条件应是?????????????。
(4)将CH4设计成燃料电池,其利用率更高,装置示意如下图(A、B为多孔性石墨棒)。持续通入甲烷,在标准状况下,消耗甲烷体积VL。
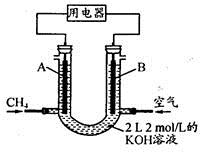
① 0<V≤44.8 L时,电池总反应方程式为??????????????????????????????????????。
② 44.8 L<V≤89.6 L时,负极电极反应为????????????????????????????????。
③ V="67.2" L时,溶液中离子浓度大小关系为??????????????????????????????。
参考答案:
(1)CH4 (g)+CO2 (g) =2CO (g
本题解析:
(1)根据盖斯定律可知,①×2-③可得CH4(g)+CO2(g)=2CO(g)+2H2(g),所以其△H=[(+206.2)×2-(+165.0)]kJ?mol-1="+247.4" kJ?mol-1,所以CH4(g)+CO2(g)=2CO(g)+2H2(g)△H="+247.4" kJ?mol-1
(2)从能量角度比较,①是吸热反应,需要消耗更多能量,②是放热反应,不需要太多能量;从原子利用率角度,由于CO+2H2→CH3OH,①的产物中氢原子不可能全部变为CH3OH,而②的产物中所有原
本题难度:一般
2、选择题 某原电池的总反应方程式为:2Fe3+ +Cu=== 2Fe2+ + Cu2+,能实现该反应的为( )
| A
| B
| C
| D
|
正极材料
| Cu
| 石墨
| Fe
| Ag
|
负极材料
| Fe
| Cu
| Cu
| Cu
|
电解质液
| CuSO4
| Fe2(SO4)3
| FeCl3
| AgNO3
参考答案:B
本题解析:
试题分析:根据总的反应式可知,铜失去电子,铁离子得到电子,所以原电池中负极材料是铜,正极材料是比铜不活泼的金属或石墨等,而电解质溶液中必须含有铁离子,例如硫酸铁等,答案选B。
考点:考查原电池的设计
点评:构成原电池的条件是活泼性不同的金属或金属和非金属,导线相连并插入到电解质溶液中,据此可以进行有关的判断。
本题难度:一般
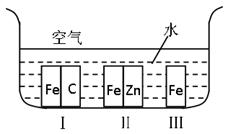
3、填空题 (14分)(1)如右图所示,铁处于Ⅰ、Ⅱ、Ⅲ三种不同的环境中,铁被腐蚀的速率由大到小的顺序是(填序号)_________??????????______。
(2)乙烷中含有乙烯除杂试剂为????????????????????;
反应的化学方程式为??????????????????????????????????????????????。
(3)在10L密闭容器中充入2molA和1molB,发生的化学反应:3A(g)+B(g)  ?C(g) ?C(g)
+2D(g),2min后反应达到平衡,在相同温度下,测得平衡时容器内气体的压强是反应前的5/6,试填写下列空白:
①用气体B表示的2min内的平均反应速率为??????????????????。
②平衡时,A的浓度为??????????????mol/L。
(4)我国拥有完全自主产权的氢氧燃料电池车在北京奥运会期间为运动员提供服务。某种氢氧燃料电池的电解液为KOH溶液。电池负极反应为??????????????????????????????,
正极反应???????????????????????????。
参考答案:(1)Ⅰ>Ⅲ>Ⅱ???(2)溴水???? CH2==CH2
本题解析:略
本题难度:简单
4、计算题 研究氮及其化合物具有重要意义。请回答下列问题:
(1)脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:
2NH3(g) +NO(g) +NO2(g) 2N2(g) +3H2O(g) △H<0,反应的氧化剂是________________。 2N2(g) +3H2O(g) △H<0,反应的氧化剂是________________。
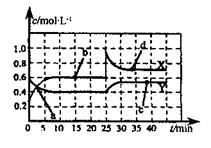
(2)巳知NO2和N2O4可以相互转化:2NO2(g) N2O4(g) △H<0,现将一定量的混合气体通入一恒温密闭容器中反应,浓度随时间变化关系如图所示。则图中两条曲线X和Y,表示N2O4浓度变化的是____,b、c、d三点的化学反应速率大小关系是______;25min时,曲线发生图中变化,可采取的措施是_________。 N2O4(g) △H<0,现将一定量的混合气体通入一恒温密闭容器中反应,浓度随时间变化关系如图所示。则图中两条曲线X和Y,表示N2O4浓度变化的是____,b、c、d三点的化学反应速率大小关系是______;25min时,曲线发生图中变化,可采取的措施是_________。
(3)25℃时,将NH3溶于水得100 mL0.1 mol ? L-1的氨水,测得pH=11,则该条件下,NH3 ? H2O的电离平衡常数Kb=_______。
(4)已知:N2(g)+O2(g)=2NO(g)?△H=+180kJ/mol;
2NO(g)+O2(g)=2NO2(g)?△H=-112kJ/mol;
2C(s)+O2(g)=2CO(g)?△H=-221kJ/mol;
C(s)+O2(g)=CO2 (g)?△H=-393.5kJ/mol。
则反应4CO(g)+2NO2(g)=4CO2 (g)+ N2(g) △H=________。
(5)用电化学法可获得N2O5。如图装置中,阳极的电极反应式为:N2O4+2HNO3-2e-=2N2O5+2H+,则该电解反应的化学方程式为________________。
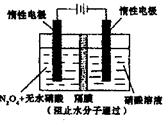
参考答案:(每空2分,共14分)(1)NO和NO2??(2)Y;
本题解析:
试题分析:(1)根据反应的方程式可知,氨气中氮元素的化合价从-3价升高到0价,失去3个电子,因此氨气是还原剂。NO和NO2中氮元素的化合价分别从+2价和+4价降低0价,得到2个和4个电子,因此氧化剂是NO和NO2。
(2)由图可知10~25min平衡状态时,X表示的生成物的浓度变化量为(0.6-0.2)mol/L=0.4mol/L,Y表示的反应物的浓度变化量为(0.6=0.4)mol/L=0.2mol/L。即X表示的生成物的浓度变化量是Y表示的反应物的浓度变化量的2倍,所以X表示NO2浓度随
本题难度:困难
5、选择题 氢氧燃料电池是一种高效、环境友好的发电装置,它是以铂作电极,KOH溶液作电解液,总反应为:2H2 + O2 = 2H2O,正极反应为:O2 + 2H2O + 4e- = 4OH-下列叙述不正确的是( )
A.H2通入负极区
B.O2通入正极区
C.负极发生氧化反应
D.正极发生氧化反应
参考答案:D
本题解析:
试题分析:A、氢氧燃料电池中燃料发生氧化反应,所以在电池的负极区通入,正确;B、氧气发生还原反应,所以在正极区通入,正确;C、电池中的负极发生氧化反应,正确;D、正极发生还原反应,错误,答案选D。
本题难度:一般
|