微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 现有a?mol/L?NaX和bmol/L?NaY两种盐溶液。下列说法正确的是
A.若a=b且c(X-)=c(Y-)+c(HY),则酸性HX>HY
B.若a>b且c(X-)=c(Y-),则酸性HXC.若a=b且pH(NaX)>pH(NaY),则酸性HX>HY
D.若两溶液等体积混合,测得c(X-)+c(Y-)+c(HX)+c(HY)=0.1mol/L,则a=b=0.1mol/L
参考答案:AB
本题解析:选项A中NaY水解,NaX不水解,因为酸越弱,相应的盐越容易水解,所以A正确。B中NaX的浓度,但c(X-)=c(Y-),这说明X-的水解程度大于Y-的,因此正确。PH越大,说明盐的水解程度越大,相应的酸就越弱,C不正确。由于混合后溶液的体积加倍,所以应该是a=b=0.2mol/L,D不正确。答案选AB。
本题难度:一般
2、选择题 下列反应中氯元素全部被还原的是
A.NH3·H2O +HCl = NH4Cl+ H2O
B.Cl2+H2O = HCl+HClO
C.Cl2+2KI = 2KCl+I2
D.MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
参考答案:C
本题解析:
试题分析:A.NH3·H2O +HCl = NH4Cl+ H2O是非氧化还原反应,氯元素的化合价没有变化,错误;B.Cl2+H2O = HCl+HclO是氧化还原反应,氯气中的氯元素的化合价部分升高,部分降低,因此部分被氧化,部分被还原,错误;C.Cl2+2KI = 2KCl+I2 氯气中的氯元素的化合价降低,得到电子被还原,正确;D.MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑中HCl的Cl的化合价一部分没有变化,一部分升高,因此一部分起酸的作用,一部分作还原剂,错误。
MnCl2+2H2O+Cl2↑中HCl的Cl的化合价一部分没有变化,一部分升高,因此一部分起酸的作用,一部分作还原剂,错误。
考点:考查化学反应中氯元素的性质及作用的知识。
本题难度:一般
3、选择题 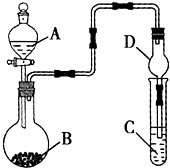 利用如图所示的装置进行实验,将液体A逐滴加入烧瓶中与B发生反应,下列有关叙述中不正确的是
利用如图所示的装置进行实验,将液体A逐滴加入烧瓶中与B发生反应,下列有关叙述中不正确的是
A.若A为硫酸,B为亚硫酸钠,C中盛品红溶液,则C中溶液褪色
B.若A为醋酸,B为贝壳,C中盛澄清石灰水,则C中溶液变浑浊
C.若A为浓氨水,B为生石灰,C中盛AgCl3溶液,则C中先产生沉淀后沉淀溶解
D.仪器D可以起到防止溶液倒吸的作用
参考答案:C
本题解析:分析:A、亚硫酸钠和硫酸反应生成二氧化硫气体,二氧化硫具有漂白作用;
B、醋酸和贝壳中碳酸钙反应生成二氧化碳气体,通入澄清石灰水变浑浊;
C、浓氨水滴入氧化钙放热使一水合氨分解生成氨气,通入氯化铝溶液中生成白色沉淀,氢氧化铝不溶于氨水;
D、D装置上部容积较大,倒吸的液体靠自身重量回落;
解答:A、亚硫酸钠和硫酸反应生成二氧化硫气体,二氧化硫具有漂白作用,通入C中品红溶液,则C中溶液褪色,故A正确;
B、醋酸和贝壳中碳酸钙反应生成二氧化碳气体,二氧化碳通入澄清石灰水变浑浊,故B正确;
C、装置中 浓氨水滴入生石灰溶解放热生成氨气,氨气通入氯化铝溶液反应生成白色沉淀,氢氧化铝不溶于弱碱中,故C错误;
D、装置中较粗的部分可以防止液体倒吸,故D正确;
故选C.
点评:本题考查气体发生装置的分析判断,气体性质的熟练掌握是解题关键,题目难度中等.
本题难度:困难
4、填空题 (12分:除注明分数的小题之外,其余为1分)铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列问题。
(1)所含铁元素既有氧化性又有还原性的物质是________(用字母代号填)。
A.Fe B.FeCl3 C.FeSO4 D.Fe2O3
(2)向沸水中逐滴滴加1 mol/L FeCl3溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是______nm。
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:___________________________________。
某校同学为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
首先取少量待测溶液,滴入KSCN溶液呈红色,则溶液中含有的金属阳离子是______________(2分),在此基础上,又进行了定量组成的测定:取50.0mL待测溶液,向其中加入足量的AgNO3溶液,得白色沉淀,过滤、干燥、称量,沉淀质量为43.05 g.溶液中c(Cl-)= mol/L.
(4)若要验证该溶液中含有Fe2+,正确的实验方法是 。
A.向试管中加入试液,滴入KSCN溶液,若显血红色,证明含有Fe2+。
B.向试管中加入试液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+。
C.向试管中加入试液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+
(5)欲从废水中回收铜,并重新获得FeCl3溶液设计实验方案如下:

A请写出上述实验中加入或生成的有关物质的化学式:
①_____________②____________③___________④____________
B请写出通入⑥的化学方程式__________________________________
参考答案:(1)C (1分);(2)1~100 (1分)
本题解析:
试题分析:(1)因元素的化合价处于中间价态时,既能升高,又能降低,既有氧化性又有还原性,只有C中铁为+2价,符合条件;(2)透明的红褐色液体是胶体,胶体的粒子直径1nm<d<100nm;(3)Fe3+能与铜反应得到Fe2+和Cu2+,离子方程式为: 2Fe3++Cu===2Fe2++Cu2+;由于滴入KSCN溶液呈红色,证明溶液中Fe3+有剩余,溶液中含有的金属阳离子是:Fe3+、Fe2+、Cu2+;43.05g沉淀是AgCl,其物质的量为0.3mol,溶液中c(Cl-)=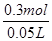 =6.0mol/L;(4)A、向试管中加入试液,滴入KSCN溶液,若显血红色,证明含有Fe3+,A错误;B、向试管中加入试液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+;B正确;C、要证明原溶液中含有Fe2+,应该是先加入硫氰化钾,不变色,再加入氯水,若显示红色,证明有Fe2+;C错误;故选B;(5)A、制取的是FeCl3溶液,金属①是Fe;滤液②是FeCl2氯化亚铁溶液;加入的铁过量,滤渣③是Fe和Cu;制取FeCl3,溶解滤渣中的铁,应加入④是盐酸; B、⑥是将Fe2+氧化成Fe3+,反应方程式是:2FeCl2+Cl2=2FeCl3。
=6.0mol/L;(4)A、向试管中加入试液,滴入KSCN溶液,若显血红色,证明含有Fe3+,A错误;B、向试管中加入试液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+;B正确;C、要证明原溶液中含有Fe2+,应该是先加入硫氰化钾,不变色,再加入氯水,若显示红色,证明有Fe2+;C错误;故选B;(5)A、制取的是FeCl3溶液,金属①是Fe;滤液②是FeCl2氯化亚铁溶液;加入的铁过量,滤渣③是Fe和Cu;制取FeCl3,溶解滤渣中的铁,应加入④是盐酸; B、⑥是将Fe2+氧化成Fe3+,反应方程式是:2FeCl2+Cl2=2FeCl3。
考点:考查铁及铁的化合物的性质、胶体的性质。
本题难度:一般
5、填空题 (16分)(2012?山东)偏二甲肼与N2O4是常用的火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2(l)+2N2O4(l)
参考答案:
本题解析:
本题难度:一般