n(C-)/mol
| a
| 0
| 0
(3)a= 。
(4)原固体混合物中各组成成分的物质的量之比为 。
参考答案:(1)NH3
(2)NH4I、MgBr2、AlCl3<
本题解析:(1)加入过量NaOH溶液并加热,生成的无色气体只能是NH3,说明一定含有NH4I。
(2)生成白色沉淀且久置无变化,说明一定无FeCl2而一定有MgBr2;根据无色溶液加适量稀盐酸→白色沉淀,加过量稀盐酸→沉淀溶解,无气泡产生,推出有AlCl3无NaHCO3。(3)由表分析可知,A-为Cl-、B-为Br-、C-为I-,比较通入 5.6 L 和2.8 L标准状况下Cl2后溶液中离子的变化情况可知:多通入2.8 L Cl2,即0.125 mol Cl2,造成Cl-增加0.25 mol, Br-减少0.1 mol,I-减少a mol,根据反应关系式:
Cl2 ~ 2Br- , Cl2 ~ 2I-
1 2 1 2
0.05 mol 0.1 mol (0.125-0.05)mol a mol
可得a=0.15
(4)由题意知,原混合溶液中n(Cl-)="1.25" mol-0.125 mol×2="1" mol,n(Br-)="1.5" mol,n(I-)="0.15" mol+0.125 mol×2="0.4" mol。则n(AlCl3)∶n(MgBr2)∶n(NH4I)=[n(Cl-)/3]∶[n(Br-)/2]∶n(I-)= mol∶ mol∶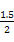 mol∶0.4 mol=20∶45∶24。 mol∶0.4 mol=20∶45∶24。
本题难度:一般
3、选择题 下列物质中含原子个数最多是 ( )
A.0.4molO2
B.5.6LCO2(标准状况)
C.4℃时5.4mLH2O
D.10gNe
参考答案:C
本题解析:A 含氧原子0.4mol
B 含原子共0.25*3=0.75mol
C 含原子共(5.4/18)*3=0.9mol
D 含原子10/40=0.25mol
所以含原子最多的是C
本题难度:一般
4、选择题 下列叙述正确的是( )
A.2.4g金属镁变为镁离子时失去的电子数为0.1NA
B.1 mo1/L盐酸中含1 mo1HCl分子
C.在标准状况下,22.4LCH4与18gH2O所含有的分子数均为NA
D.22.4L的CO气体与lmol N2所含的原子数一定相等
参考答案:C
本题解析:A错误,镁经过化学反应变成镁离子是+2价离子,失去电子数应该为0.2NA
B错误,盐酸体积没告诉,无法求得溶质物质的量,另外HCl是强电解质,在溶液里是完全电离成氢离子和氯离子,所以不存在HCl分子.
C正确.
D错误,一氧化碳所处的温度压强没有告诉是否是标准状态,无法求得其物质的量.
本题难度:一般
5、选择题 下列溶液中的c(Cl-)与50mL1mol/L氯化铝溶液中的c(Cl-)相等的是
A.150mL1mol/L氯化钠溶液
B.75mL2mol/L 氯化铵溶液
C.150mL1mol/L氯化钾溶液
D.75mL3mol/L氯化钾溶液
参考答案:D
本题解析:
试题分析:50mL 1mol?L-1AlCl3溶液中,氯离子的物质的量浓度为:1mol?L-1×3=3mol?L-1,A、150 mL 1 mol?L-1NaCl溶液中,Cl-浓度为1mol?L-1×1=1mol?L-1,故A错误;B、75 mL 2mol?L-1氯化铵溶液中,Cl-浓度为2mol?L-1×1=2mol?L-1,故B错误;C、150 mL 1 mol?L-1KCl溶液中,Cl-浓度为1mol?L-1×1=1mol?L-1,故C错误;D、75mL 3mol?L-1KCl溶液中,Cl-浓度为1mol?L-1×3=3mol?L-1,故D正确;故选D.
考点:物质的量浓度
本题难度:一般
|