微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列叙述中能肯定判断化学平衡发生了移动的是( )
A.体系中气体的密度发生变化
B.体系中各组分的物质的量浓度发生变化
C.体系中各组分的体积分数发生变化
D.正反应和逆反应速率均发生变化
2、选择题 可以证明可逆反应N2+3H2?2NH3已达到平衡状态的是( )
①一个N≡N断裂的同时,有3个H-H键断裂;
②一个N≡N键断裂的同时,有6个N-H键断裂;
③其他条件不变时,混合气体平均相对分子质量不再改变;
④保持其他条件不变时,体系压强不再改变;
⑤NH3%、N2%、H2%都不再改变;
⑥恒温恒容时,密度保持不变;
⑦正反应速率v(H2)=0.6mol/(L?min),逆反应速率v(NH3)=0.4mol/(L?min)
A.全部
B.②③④⑤⑥⑦
C.②③④⑤⑦
D.③④⑤⑥⑦
3、选择题 可逆反应H2(g)+I2(g)?2HI(g)达到平衡的标志是( )
A.H2、I2、HI的浓度相等
B.H2、I2、HI的浓度保持不变
C.混合气体的密度保持不变
D.混合气体的质量不再改变
4、选择题 将2mol?SO2和1mol?O2充入一容积固定的密闭容器中,在一定条件下反应:2SO2(g)+O2(g)?
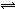
?2SO3(g),下列情况能说明该可逆反应已达化学平衡状态的是( )
A.每生成1molSO2的同时,消耗1molSO3
B.混合气体的质量不再变化
C.每生成1molSO3的同时,消耗1molSO3
D.每生成1molSO3的同时,消耗0.5molO2
5、简答题 原创工业上一般在恒容密闭容器中用H2和CO生产燃料甲醇,反应方程式为
CO(g)+2H2(g)

CH3OH(g)△H
(1)下表所列数据是反应在不同温度下的化学平衡常数(K).
| 温度 | 250°C | 300°C | 350°C
K
2.041
0.270
0.012
①由表中数据判断△H______0(填“>”、“=”或“<“)
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为______,此时的温度为______.
(2)在100℃压强为0.1MPa条件下,容积为V?L某密闭容器中a?mol?CO与?2a?mol?H2在催化剂作用下反应生成甲醇,达平衡时CO的转化率为50%,则100℃该反应的平衡常数K=______(用含a、V的代数式表示并化简至最简单的形式).此时保持温度容积不变,再向容器中充入a?mol?CH3OH(g),平衡______(向正反应方向、向逆反应方向)移动,再次达到新平衡时,CO的体积分数______.(减小、增大、不变)
(3)要提高CO的转化率,可以采取的措施是______.
A.升温??????????????? B.加入催化剂????????????? C.增加CO的浓度
D.恒容充入H2 E.恒压充入惰性气体????????F.分离出甲醇
(4)判断反应达到平衡状态的依据是(填字母序号,下同)______.
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的相对平均分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
(5)300°C,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡的有关数据如下:
| 容器 | 甲 | 乙 | 丙
| 反应物投入量
1molCO、2moL?H2
1molCH3OH
2molCH3OH
| 平
衡
时
的
数
据
CH3OH浓度(mol/L)
c1
c2
c3
反应的能量变化
akJ
bkJ
ckJ
体系压强(Pa)
p1
p2
p3
反应物转化率
α1
α2
α3
请选择正确的序号填空(不定项选择)
①c1、c2、c3的关系表达正确的为______
A??c3>2c1??????B?c1<c3<2c1??????C?c1=c2
②a、b、c的关系表达正确的为______
A???c<2|△H|B??a+b=|△H|C??c=2b
③p1、p2、p3的关系不正确的为______
A??p1=p2??????B??p2<p3<2p2???????C??p3>2p2
④a1、a2、a3的关系表达不正确的为______
A??a1=a2???????B?a3<a2??????C??a1+a2=1.
|
|