微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 在80℃时,将0.40mo1的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4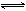 2NO2?△H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2?△H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
?????? t/s
n/mol
| 0
| 20
| 40
| 60
| 80
| 100
|
n(N2O4)
| 0.40
| a
| 0.20
| c
| d
| e
|
n(NO2)
| 0.00
| 0.24
| b
| 0.52
| 0.60
| 0.60
(1)计算0~20s内用NO2表示的平均反应速率为?????mo1?L—1?s—1。
(2)计算在80℃时该反应的平衡常数K=????(请注明单位)。
(3)反应进行至100s后将反应混合物的温度升高,混合气体的颜色????(填“变浅”“变深”或“不变”)。
(4)要增大该反应的K值,可采取的措施有????(填序号)。
A.增大N2O4的起始浓度
C.使用高效催化剂
B.向混合气体中通入NO2
D.升高温度
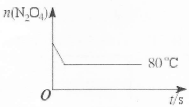
(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出(不用计算,定性处理)该反应在60℃时N2O4物质的量的变化曲线。
参考答案:(1)0.006???
(2)1.8mol/L??
本题解析:
试题分析:(1)v(NO2)=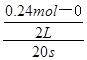 =0.006mol/(L?min);(2)起始时c(N2O4)= =0.006mol/(L?min);(2)起始时c(N2O4)=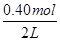 =0.20m =0.20m
本题难度:一般
2、计算题 (6分)把0.6 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,它们发生如下反应:
2X(g)+Y(g) = nZ(g)+2W(g) 。2 min 末已生成0.2 mol W ,若以Z的浓度变化表示的反应速率为0.1 mol·L-1·min-1,计算:
(1)化学反应方程式中n的值是多少?
(2)2 min末时Y的浓度?
参考答案:(1)?? n =" 4?????????" (2) 0.2
本题解析:略
本题难度:简单
3、选择题 一定温度下恒容的密闭容器中,反应A2(g)+B2(g)?2AB(g)达到平衡的标志是( )
A.正反应速率和逆反应速率相等且都为零
B.容器内气体的总压强不随时间变化
C.单位时间内生成2n?mol?AB的同时生成n?mol?B2
D.容器内气体的平均相对分子质量不随时间变化
参考答案:A.正反应速率和逆反应速率相等且都不为零是化学平衡状态的标志
本题解析:
本题难度:简单
4、选择题 可逆反应2NO2(g)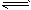 2NO(g) + O2(g),在体积不变的密闭容器中反应,达到平衡状态的标志是[???? ] 2NO(g) + O2(g),在体积不变的密闭容器中反应,达到平衡状态的标志是[???? ]
①单位时间内生成n molO2的同时生成2n molNO2
②单位时间内生成n molO2的同时生成2n molNO
③NO2、NO、O2的物质的量浓度比值为2∶2∶1
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的总压强不再改变的状态
A.①④⑥
B.②③⑤
C.①③④
D.全部
参考答案:A
本题解析:
本题难度:一般
5、填空题 (14分)二甲醚(CH3OCH。)和甲醇(CH3OH)被称为21世纪的新型燃料,具有清洁、高效等优良的性能。以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下:
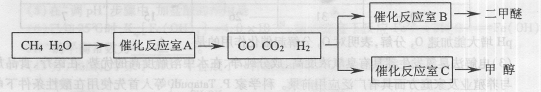
(1)催化反应室B中CO 与H2合成二甲醚的化学方程式为??????????. 与H2合成二甲醚的化学方程式为??????????.
(2)催化反应室A中发生的反应为:
CH4(g)+H2O(g) CO(g)+3H2(g)……(I)、CO(g)+H2O(g) CO(g)+3H2(g)……(I)、CO(g)+H2O(g) CO2(g)+H2(g)……(Ⅱ)催化反应室C中发生的反应为: CO2(g)+H2(g)……(Ⅱ)催化反应室C中发生的反应为:
CO(g)+2H2(g) CH3OH(g)……(Ⅲ)、CO2(g)+3H2(g) CH3OH(g)……(Ⅲ)、CO2(g)+3H2(g) CH3OH(g)+H2O(g)……(Ⅳ) CH3OH(g)+H2O(g)……(Ⅳ)
①已知:原子利用率= ×100%,试求反应(Ⅳ)的原子利用率为???????。 ×100%,试求反应(Ⅳ)的原子利用率为???????。
②反应(Ⅳ)的△S ????????0(填“>”、“=”或“<”)。
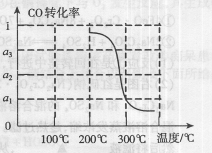
③在压强为5MPa,体积为VL的反应室c中,amol CO与20mol H2在催化剂作用下发生反应(Ⅲ)生成甲醇,CO的转化率与温度的关系如右图。则该反应的△H?????0(填“>”、“=”或“<”)。300℃时该反应的平衡常数K= ????????(用含字母的代数式表示)。
(3)我国某科研所提供一种碱性“直接二甲醚燃料电池”。
该燃料电池负极的电极反应式为:
CH3OCH3一12e一+16OH一=2CO2-3+11H2O。有人提出了一种利用氯碱工业产品治理含二氧化硫(体积分数为x)废气的方法如下:
①将含SO2的废气通人电解饱和食盐水所得溶液中,得NaHSO3溶液;
②将电解饱和食盐水所得气体反应后制得盐酸;
③将盐酸加入NaHSO3溶液中得SO2气体回 收。 收。
用上述碱性“直接二甲醚燃料电池”电解食盐水来处理标准状况下VL的废气,计算消耗二甲醚的质量。
参考答案:
 本题解析:略 本题解析:略
本题难度:简单
|