微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温下0.1mol/L碳酸溶液中,下列离子关系式正确的是
A.c(H+)="2" c(CO32-)+c(OH-)
B.0.1= c(HCO3-)+2c(CO32-)
C.c(OH-)= c(H+) - c(HCO3-)-2 c(CO32-)
D.c(H+)>c(CO32-) > c(HCO3-)
参考答案:C
本题解析:选项A不正确,不符合电荷守恒定律,应该是c(H+)="2" c(CO32-)+c(OH-)+c(HCO3-),因此选项C正确;选项B不正确,不符合物料失衡,应该是0.1= c(HCO3-)+c(CO32-)+c(H2CO3);碳酸的第二步电离程度很小,选项D不正确,应该是c(H+) > c(HCO3-)>c(CO32-),答案选C。
本题难度:困难
2、选择题 等体积、等物质的量浓度的NaCl和NaF溶液中,阴阳离子总数相比 ( )
A.前者多
B.后者多
C.一样多
D.无法判断
参考答案:B
本题解析:
正确答案:B
NaF是强碱弱酸盐,F++H2O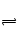 HF+OH
HF+OH
本题难度:一般
3、选择题 室温下,将一定浓度的一元酸HA溶液和一定浓度的NaOH溶液等体积混合(忽略体积变化),实验数据如下表:

下列判断不正确的是
A.实验①反应的溶液中:c(Na+)>c(A-)>c(OH-)>c(H+)
B.实验①反应的溶液中:c(OH-)= c(Na+)-c(A-)=Kw/(1×10-9)mol/L
C.实验②反应的溶液中:c(A-)+c(HA)>0.1mol/L
D.实验②反应的溶液中:c(Na+)= c(A-)> c(OH-)=c(H+)
参考答案:B
本题解析:
试题分析:A.根据表格中实验①数据可知HA为弱酸,二者恰好完全反应产生盐NaA,该盐是强碱弱酸盐,A-发生水解反应而消耗,所以c(Na+)>c(A-),水解消耗水电离产生的H+,当最终达到平衡时,c(OH-)>c(H+)。但是盐水解的程度是微弱的,主要是以盐电离产生的离子存在,所以c(A-)>c(OH-)。故溶液中离子浓度大小关系为:c(Na+)>c(A-)>c(OH-)>c(H+),正确;B. 根据电荷守恒和实验①所得溶液的pH=9可得:c(OH—)=c(Na+)+c(H+)—c(A—)=Kw/(1×10—9) mol/L,错误;C. 由于HA是弱酸,若要使溶液的pH=7,则实验②c(HA)>0.2mol/L,所以[c(A-)+c(HA)]÷2>0.1mol/L,正确;D.根据电荷守恒可得:c(Na+) +c(H+)= c(A-)+ c(OH-),溶液的pH=7,则c(OH-)=c(H+),盐是强电解质,电离程度远大于水的电离,所以实验②反应的溶液中:c(Na+)= c(A-)> c(OH-)=c(H+),正确。
考点:考查电解质溶液的离子浓度比较及其三大守恒原理的知识。
本题难度:困难
4、选择题 常温下,下列有关离子浓度及pH大小的比较,正确的是
A.NH4+浓度相同的下列溶液:①(NH4)2Fe(SO4)2②(NH4)2CO3③(NH4)2SO4,溶液浓度由大到小的顺序是:③>②>①
B.由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,其离子浓度不可能是:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C.pH=13的Ba(OH)2溶液与pH=1的HCl溶液等体积混合后,混合溶液的pH>7
D.pH=12的Ba(OH)2溶液与pH=14的NaOH溶液等体积混合,混合溶液的pH范围是13<pH<14
参考答案:D
本题解析:
本题难度:一般
5、填空题 根据下列要求写出有关反应式:
(1)钢铁发生吸氧腐蚀时,正极反应式:_____________________;
(2)用石墨作电极电解饱和食盐水的总反应:_____________________;
(3)将石墨接负极,铜板接正极,当通以直流电时,电解硫酸铜溶液,发生氧化反应的电极反应式:
_____________________ ;
(4)向明矾溶液中逐滴加入氢氧化钡溶液至硫酸根离子刚好沉淀完全时,离子反应方程式:
_____________________;
(5)蒸干AlCl3溶液,并灼烧。涉及到的化学反应方程式:_____________________。
参考答案:(1)2H2O+O2+4e-==4OH-
(2)2N
本题解析:
本题难度:一般