微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)(1)已知:Fe(s)+ O2(g)=FeO(s) △H=-272.0kJ?mol-1
O2(g)=FeO(s) △H=-272.0kJ?mol-1
2Al(s)+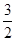 O2(g)=Al2O3(s) △H=-1675.7kJ?mol-1
O2(g)=Al2O3(s) △H=-1675.7kJ?mol-1
Al和FeO发生铝热反应的热化学方程式是 。
(2)某可逆反应在不同条件下的反应历程分别为A、B,如图所示。
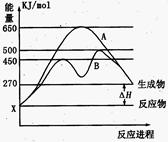
①据图判断该反应是 (填“吸”或“放”)热反应,当反应达到平衡后,其他条件不变,升高温度,反应物的转化率 (填“增大”、“减小”或“不变”);
②其中B历程表明此反应采用的条件为 (选填序号)。
A.升高温度 B.增大反应物的浓度
C.降低温度 D.使用催化剂
(3)1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(S)+4H2(g) Na2S(s)+4H2O(g)。该反应的平衡常数表达式为 ;已知K1000℃ < K1200℃, 若降低体系温度,混合气体的平均相对分子质量将 (填“增大”、“减小”或“不变”)。
Na2S(s)+4H2O(g)。该反应的平衡常数表达式为 ;已知K1000℃ < K1200℃, 若降低体系温度,混合气体的平均相对分子质量将 (填“增大”、“减小”或“不变”)。
(4)常温下,如果取0.1mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8。
①混合液中由水电离出的OH-浓度与0.1mol·L-1NaOH溶液中由水电离出的OH-浓度之比为 ;
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7(填“<”、“>”或“=”);相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排列顺序为(填序号) 。
a.NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl
参考答案:(1)2Al(s)+3FeO(s)=Al2O3(s)+3Fe
本题解析:
试题分析:(1)①Fe(s)+ O2(g)=FeO(s)△H=-272.0kJ?mol-1,②2Al(s)+
O2(g)=FeO(s)△H=-272.0kJ?mol-1,②2Al(s)+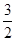 O2(g)=Al2O3(s)△H=-1675.7kJ?mol-1,依据盖斯定律②-①×3得到热化学方程式为:2Al(s)+3FeO(s)=Al2O3(s)+3Fe(s) △H=-859.7 kJ?mol-1;
O2(g)=Al2O3(s)△H=-1675.7kJ?mol-1,依据盖斯定律②-①×3得到热化学方程式为:2Al(s)+3FeO(s)=Al2O3(s)+3Fe(s) △H=-859.7 kJ?mol-1;
(2)①由图可知,反应物的总能量低于生成物的总能量,该反应为吸热反应;升高温度平衡向正反应方向移动,反应物的转化率增大;
②由图可知,反应历程B与A相比,改变反应历程,活化能降低,应是使用催化剂,故答案为:D;
(3)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以可逆反应Na2SO4(S)+4H2(g) Na2S(s)+4H2O(g)的平衡常数表达式k=
Na2S(s)+4H2O(g)的平衡常数表达式k=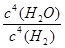 ;K1000℃<K1200℃,这说明升高温度平衡常数增大,即平衡向正反应方向移动,因此正反应为吸热反应。降低体系温度,平衡向逆反应方向移动,混合气体总质量减小,总的物质的量不变,故混合气体的平均相对分子质量将减小;
;K1000℃<K1200℃,这说明升高温度平衡常数增大,即平衡向正反应方向移动,因此正反应为吸热反应。降低体系温度,平衡向逆反应方向移动,混合气体总质量减小,总的物质的量不变,故混合气体的平均相对分子质量将减小;
(4)①盐溶液中c(OH-)=10-14÷10-8=10-6 mol/L,0.1mol?L-1NaOH溶液中c(H+)等于由水电离出的氢氧根离子浓度,即c(H+)=c水电离(OH-)=10-14÷0.1=10-13 mol/L,所以混合液中由水电离出的OH-浓度与0.1mol?L-1NaOH溶液中由水电离出的OH-浓度之比=10-6 mol/L:10-13 mol/L=107:1;
②将HA溶液加到Na2CO3溶液中有气体放出,说明HA的酸性比碳酸的强,NH4A溶液为中性,说明相同条件下,氨水和HA的电离程度相同,所以(NH4)2CO3中铵根离子的水解程度小于碳酸根离子的水解程度,所以溶液的pH>7;NH4Cl是强酸弱碱盐,铵根离子水解导致溶液呈酸性;NH4A溶液中阴阳离子的水解程度相等,所以溶液呈中性,溶液的pH值大于氯化铵;NH4HCO3溶液中铵根离子的水解程度小于碳酸氢根离子的水解程度,溶液呈碱性;(NH4)2CO3溶液中碳酸根的水解程度更大,pH值最大。
考点:考查热化学方程式的书写、化学平衡常数、平衡移动、电解质溶液有关计算、盐类水解等
本题难度:困难
2、选择题 下列溶液中有关物质的量浓度关系不正确的
A.pH=2的HA溶液与pH=12的MOH溶液以任意比混合:c(H+)+c(M+)=c(OH-)+c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)
D.0.1 mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(A2-)>c(H2A)
参考答案:B
本题解析:
试题分析:A.PH=2的HA溶液与PH=12的MOH溶液任意比混合,酸和碱发生反应后的溶液中存在的离子有:H+、M+、OH-、A-,无论酸碱的相对多少如何,溶液总是呈电中性的,根据电荷守恒有:c(H+)+c(M+)=c(OH-)+c(A-) ,A正确;B.PH相等的CH3COONa , NaOH, Na2CO3三种溶液中,NaOH的浓度最小,因为它是强碱,Na2CO3的浓度小于CH3COONa的浓度,因为醋酸比碳酸强,所以Na2CO3的水解程度大于CH3COONa,B错误;C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合,即混合溶液中CH3COOH和CH3COONa物质的量相等,假设它们的物质的量均为1mol,溶液中存在以下三个平衡:CH3COOH CH3COO- + H+
CH3COO- + H+
CH3COO- + H2O CH3COOH+OH- H2O
CH3COOH+OH- H2O H++OH-,根据电荷守恒:c(CH3COO-)+c(OH-)=c(H+)+c(Na+) ①根据物料守恒:c(CH3COO-)+c(CH3COOH)=2c(Na+) ②将①代入②消去2c(Na+)即得:c(CH3COO-)+2c(OH-)=c(CH3COOH)+2c(H+) ,C正确;D. 0.1moL/L的NaHA溶液中存在三个平衡;H2O
H++OH-,根据电荷守恒:c(CH3COO-)+c(OH-)=c(H+)+c(Na+) ①根据物料守恒:c(CH3COO-)+c(CH3COOH)=2c(Na+) ②将①代入②消去2c(Na+)即得:c(CH3COO-)+2c(OH-)=c(CH3COOH)+2c(H+) ,C正确;D. 0.1moL/L的NaHA溶液中存在三个平衡;H2O H++OH- HA-+H2O
H++OH- HA-+H2O H2A + OH- HA-
H2A + OH- HA- H++A2-,已知其PH=4,说明电离强于水解,即c(HA-)>c(H+)>c(A2-)>c(H2A),D正确;选B。
H++A2-,已知其PH=4,说明电离强于水解,即c(HA-)>c(H+)>c(A2-)>c(H2A),D正确;选B。
考点:考查混合溶液中离子浓度的大小比较。
本题难度:困难
3、选择题 NH4Cl溶于重水(D2O)后,产生的一水合氨和水合氢离子均表示正确的是[???? ]
A.NH2D·H2O和D3O+
B.NH3·D2O和HD2O+
C.NH3·HDO和D3O+
D.NH2D·HDO和H2DO+
参考答案:C
本题解析:
本题难度:一般
4、选择题 草酸是中强酸,草酸氢钾溶液呈酸性。在0.1 mol·L-1 KHC2O4溶液中,下列关系正确的是
①c(K+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-)
②c(HC2O4-)+c(C2O42-)=0.1 mol·L-1
③c(C2O42-)>c(H2C2O4)
④c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-)
A.①②
B.①④
C.③④
D.②③
参考答案:C
本题解析:
试题分析:
①根据电荷守恒,有c(K+)+c(H+)=c(HC2O4-)+c(OH-)+2c(C2O42-),故①错误;
②草酸氢钾溶液中存在H2C2O4、C2O42-、HC2O4-,根据物料守恒可知c(H2C2O4)+c(C2O42-)+c(HC2O4-)=0.1mol/L,故②错误;
③草酸氢钾溶液呈酸性,说明HC2O4-电离程度大于水解程度,则c(C2O42-)>c(H2C2O4),故③正确;
④在0.1mol?L-1KHC2O4溶液中,存在H2C2O4、C2O42-、HC2O4-和K+,根据物料守恒可知c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-),故④正确.
考点:考查盐类的水解、电荷守恒、物料守恒的应用
点评:本题考查了盐类的水解、电荷守恒、物料守恒的应用,难度中等。解题时应注意题目所给的信息,草酸是中强酸,草酸氢钾溶液呈酸性,据此判断出HC2O4-电离程度大于水解程度。
本题难度:困难
5、选择题 常温下,下列各溶液的叙述中正确的是
A.NaHSO3与Na2SO3混合溶液中:3c(Na+)=c(HSO3-)+c(SO32-)
B.0.1 mol/L的醋酸钠溶液20 mL与0.1 mol/L盐酸10 mL混合后溶液显酸性:
c(CH3COO-)>c(CH3COOH) >c(Cl-)>c(H+)
C.等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-)
D.向1.00 L 0.3 mol/LNaOH溶液中缓慢通入0.2 mol CO2气体,溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
参考答案:C
本题解析:
试题分析:A.在NaHSO3与Na2SO3混合溶液中:根据物料守恒, c(Na+)=3c(HSO3-)+3c(SO32-)+3c(H2SO3),Na+离子的浓度最大,错误;B.0.1 mol/L的醋酸钠溶液20 mL与0.1 mol/L盐酸10 mL混合后溶液是NaCl、CH3COONa、CH3COOH等物质的量的混合溶液,由于溶液显酸性,说明:CH3COOH的电离作用大于CH3COO-的水解作用,所以c(CH3COO-)>c(CH3COOH);c(Cl-)>c(CH3COOH) ,弱酸的电离作用是微弱的,物质主要以电解质分子的形式存在所以c(CH3COOH) > c(H+),故溶液中离子浓度关系是c(CH3COO-) >c(Cl-)>c(CH3COOH) > c(H+),错误;C.等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:c(Na+)=c(SO42-),由于铵根离子会发生水解作用消耗水电离产生的OH-,最终使溶液显酸性,所以c(SO42-)>c(NH4+), c(H+)>c(OH-)。但是盐的水解作用是微弱的,主要以盐的离子的形式存在,所以c(NH4+)>c(H+),因此溶液中两种浓度关系是c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-),正确;D.向1.00 L 0.3 mol/LNaOH溶液中缓慢通入0.2 mol CO2气体,会发生反应CO2+2NaOH=Na2CO3+H2O NaOH +CO2 =NaHCO3 根据Na元素守恒可得2n(Na2CO3)+n(NaHCO3)=0.3ml;根据C元素守恒可得n(Na2CO3)+n(NaHCO3)=0.2mol,解得n(Na2CO3)=n(NaHCO3)=0.1mol。由于Na2CO3水解程度大于NaHCO3,所以c(HCO3-)>c(CO32-),二者水解是显碱性,所以c(OH-)>c(H+),但是盐的水解程度是微弱的,主要以盐的离子存在,所以c(CO32-)> c(OH-)。故溶液中离子浓度大小关系是c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),错误。
考点:考查溶液中离子浓度的大小比较的知识。
本题难度:一般