微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol/L NaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
A.V(NaOH)=0时,c(H+)=1×10-2 mol/L
B.V(NaOH)=10 mL时,c(H+)=1×10-7 mol/L
C.V(NaOH)<10 mL时,可能存在c(Na+)=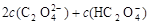
D.V(NaOH)>10 mL时,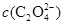 >
>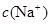 >
>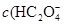 )
)
参考答案:C
本题解析:
试题分析:A、由于草酸根是弱酸跟离子,所以不能完全电离出氢离子,V(NaOH)=0时,c(H+)<1×10-2 mol/L故错。
B. V(NaOH)=10 mL时,由于草酸氢钠溶液过量,所以溶液溶液呈酸性,c(H+)>1×10-7 mol/L
C. V(NaOH)<10 mL时,根据物料守恒可知,可能存在c(Na+)=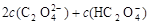
D.V(NaOH)>10 mL时,溶液中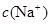 >
>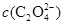 >
>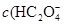 )故错。
)故错。
考点:弱酸根离子的水解,离子浓度大小的比较。
点评:本题难度大,主要考察溶液中弱酸根离子的水解作用,溶液过量问题,加入碱的量会使水解平衡移动。
本题难度:困难
2、选择题 100mL0.1mol/L的下列溶液中,阴离子总数多少的排列顺序正确的是
①CaCl2 ②CH3COONa ③NaCl ④Na2CO3
A.①>④>③>②
B.①>④>③=②
C.①>④=③=②
D.①>④>②>③
参考答案:A
本题解析:
试题分析:①氯化钙阴离子的物质的量为:0.1L×0.1mol/L×2=0.02mol。②醋酸钠中阴离子的物质的量为:0.1L×0.1mol/L=0.01mol,又因为醋酸根水解,故小于0.01mol。③氯化钠中阴离子物质的量为:0.1L×0.1mol/L=0.01mol。④碳酸钠中阴离子的物质的量为:0.1L×0.1mol/L=0.01mol,由于碳酸根水解,CO32-+H2O HCO3-+OH-故大于0.01mol。故①>④>③>②。
HCO3-+OH-故大于0.01mol。故①>④>③>②。
考点:盐类水解
本题难度:一般
3、选择题 下列过程或现象与盐类水解无关的是
A.草木灰不能与铵混合使用态氮肥
B.铁在潮湿的环境下生锈
C.加热氯化铁溶液颜色变深
D.浓硫化钠溶液有臭味
参考答案:B
本题解析:
试题分析:A、草木灰不能与铵混合使用态氮肥,是因为草木灰(主要成分为碳酸钾)中的碳酸根离子与氮肥中的氨根离子发生双水解,正确;B、铁在潮湿的环境下生锈,是因为形成了原电池,错误;C、加热氯化铁溶液颜色变深,是因为铁离子水解程度增大,生成了氢氧化铁而已,正确;D、浓硫化钠溶液有臭味,是因为硫化钠中的硫离子水解生成硫化氢,加热后水解程度增大,硫化氢气体放出,正确。
考点:考查盐类的水解。
本题难度:一般
4、选择题 在溶液中不能发生水解的离子是[???? ]
A.HS-
B.CO32-
C.Fe3+
D.Br-
参考答案:D
本题解析:
本题难度:一般
5、填空题 (10分)(1)AgNO3的水溶液呈 (填“酸”“中”或“碱”)性,原因是(用离子方程式表示): ;实验室在配制AgNO3溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”或“抑制”)其水解。
(2)明矾溶于水其中铝离子水解可用于净水,用离子方程式表示:
(3)纯碱可代替洗涤剂洗涤餐具,原因是(用离子方程式表示):
参考答案:(1)酸 Ag+ + H2O
本题解析:
试题分析:(1)AgNO3是强酸弱碱盐,水解显酸性,水解的离子方程式为Ag+ + H2O 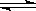 AgOH + H+由于水解会生成杂质,所以加入硝酸来抑制水解。(2)铝离子水解的离子方程式为:Al3+ +3H2O
AgOH + H+由于水解会生成杂质,所以加入硝酸来抑制水解。(2)铝离子水解的离子方程式为:Al3+ +3H2O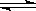 Al(OH)3 +3H+(3)纯碱是碳酸钠,是强碱弱酸盐,水解溶液显碱性,碱性条件下油污会发生水解而被除去,CO32-水解的离子方程式为:CO32- + H2O
Al(OH)3 +3H+(3)纯碱是碳酸钠,是强碱弱酸盐,水解溶液显碱性,碱性条件下油污会发生水解而被除去,CO32-水解的离子方程式为:CO32- + H2O 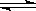 HCO3- +OH-
HCO3- +OH-
考点:盐类水解的应用和离子方程式的书写。
本题难度:一般