微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在硫酸铁溶液中,加入a?g?铜,完全溶解后,又加入b?g铁,充分反应后得到c?g残余固体,且b<c,则下列判断正确的是
A.最后得到的溶液中不含有Cu2+
B.残余固体一定全部是铜
C.最后得到的溶液中只含Cu2+
D.残余固体可能为铁、铜混合物
参考答案:D
本题解析:由于b小于c,所以最终所得的固体一定含有铜,但也可能含有铁,因此选项D正确,其余都是错误的,答案选D。
本题难度:困难
2、选择题 下列做法中,合理的是
A.洗涤蔬菜时,放入水中浸泡几分钟
B.长时间进行喷洒农药作物
C.不戴口罩使用有机磷农药
D.使用刚喷洒过农药的瓜果
参考答案:A
本题解析:分析:农药进入人体产生中毒的途径有3种,即经口,通过消化道进入;经皮,通过皮肤吸收;吸入,通过呼吸道进入.因此,防止农药中毒事故的主要措施都应针对这三种中毒途径,要尽可能防止农药从口、鼻、皮肤进入人体,而其中重点应防止皮肤污染;但不能禁用农药.
解答:A.洗涤蔬菜时,放入水中浸泡几分钟以去除残留农药,故A正确;
B.长时间进行喷洒农药作物会使残留农药增多,故B错误;
C.喷洒农药时注意个人防护,戴口罩使用有机磷农药,故C错误;
D.严禁采摘和使用刚喷洒过农药的瓜、果、蔬菜等,故D错误;
故选:A;
点评:本题考查农药的使用,难度不大,正确合理使用化学农药,是有效防治病虫害、提高作物品质和增加经济效益的关键.
本题难度:困难
3、选择题 下列叙述正确的是
A.还原性:Na>K
B.热稳定性:NaHCO3>Na2CO3
C.等物质的量的NaHCO3和Na2CO3分别跟足量盐酸反应,消耗HCl的物质的量比为1:2
D.等质量的NaHCO3和Na2CO3分别跟足量盐酸反应,产生CO2的物质的量比为1:2
参考答案:C
本题解析:分析:同主族元素从上到下,元素的金属性逐渐增强,NaHCO3不稳定,加热易分解,与盐酸反应时,Na2CO3+2HCl=2NaCl+H2O+CO2↑(盐酸过量),NaHCO3+HCl=NaCl+H2O+CO2↑,NaHCO3反应剧烈,结合反应的方程式计算和判断.
解答:A.金属性Na<K,元素的金属性越强,对应的单质的还原性越强,故A错误;
B.碳酸氢钠不稳定,加热分解生成碳酸钠和二氧化碳气体,方程式为2NaHCO3 Na2CO3+CO2↑+H2O,故B错误;
Na2CO3+CO2↑+H2O,故B错误;
C.等物质的量的NaHCO3和Na2CO3分别跟足量盐酸反应,分别发生Na2CO3+2HCl=2NaCl+H2O+CO2↑(盐酸过量),NaHCO3+HCl=NaCl+H2O+CO2↑,消耗HCl的物质的量比为1:2,故C正确;
D.等质量的NaHCO3和Na2CO3分别跟足量盐酸反应,NaHCO3物质的量较大,产生CO2的物质的量比为 :
: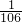 ,故D错误.
,故D错误.
故选C.
点评:该题考查碳酸钠与碳酸氢钠的性质比较,是高考中的常见考点,属于中等难度的试题.试题针对性强,紧扣教材基础知识,有利于培养分析、归纳和总结问题的能力.该题的关键是熟练记住二者的性质差异,然后结合题意灵活运用即可.
本题难度:一般
4、选择题 据医学报道,常吃盐腌菜者比不吃者得胃癌的相对危险性高5-6倍,这是因为腌菜发酵时
A.纤维素被水解为葡萄糖
B.氯化钠中含有一定量的氯化镁
C.硝酸盐被还原为亚硝酸盐
D.Na+和Cl-的浓度大大增加
参考答案:C
本题解析:腌菜过程中,硝酸盐转化为亚硝酸盐,氮元素化合价降低.而亚硝酸盐是世界卫生组织公认的致癌物质之一.
本题难度:困难
5、选择题 某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+.取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀.由此可知原溶液中
A.至少存在5种离子
B.Cl-一定存在,且c(Cl?)≥0.4mol/L
C.SO42-、NH4+、一定存在,Cl-可能不存在
D.CO32-、Al3+一定不存在,K+可能存在
参考答案:B
本题解析:分析:加入过量NaOH溶液,加热,得到0.02mol气体,可知一定存在铵离子;
红褐色沉淀是氢氧化铁,1.6g固体为三氧化二铁,可知一定有Fe3+,一定没有CO32-;
4.66g不溶于盐酸的沉淀,硫酸钡沉淀,物质的量为:0.02mol;
根据以上数据推算存在离子,根据电荷守恒推算氯离子的存在及数据.
解答:由于加入过量NaOH溶液,加热,得到0.02mol气体,说明一定有NH4+,且物质的量为0.02mol;同时产生红褐色沉淀,说明一定有Fe3+,1.6g固体为氧化铁,物质的量为0.01mol,故有0.02molFe3+,一定没有CO32-;
? 4.66g不溶于盐酸的沉淀为硫酸钡,一定有SO42-,物质的量为0.02mol;
? 根据电荷守恒,一定有Cl-,至少 0.02mol×3+0.02-0.02mol×2=0.04mol,物质的量浓度至少 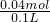 =0.4mol/L,
=0.4mol/L,
A、至少存在Cl-、SO42-、NH4+、Fe3+四种离子,故A错误;
B、根据电荷守恒,至少存在0.04molCl-,故B正确;
C、一定存在氯离子,故C错误;
D、Al3+无法判断是否存在,故D错误;
故选B.
点评:本题考查离子共存知识,做题是认真阅读、分析题中数据,合理分析,特别是氯离子的推断,难度中等.
本题难度:简单