微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某晶体的一部分如下图所示,这种晶体中A、B、C三种粒子数之比是(??? )
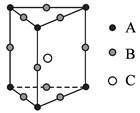
A.3∶9∶4???????B.1∶4∶2?????????? C.2∶9∶4???????D.3∶8∶4
参考答案:B
本题解析:这不是一个平行六面体晶胞,而是一个正三棱柱结构,它分摊到的各个粒子数目分别为:顶点1/12,水平棱上1/4,竖直棱上1/6,面上1/2,内部1。所以A、B、C三种粒子数之比为(6×1/12)∶(6×1/4+3×1/6)∶1=1∶4∶2
本题难度:一般
2、选择题 下列分子或离子中键角由大到小排列顺序是[???? ]
①BF3 ②NH3 ③H2O ④NH4+ ⑤BeCl2
A.⑤④①②③
B.⑤①④②③
C.④①②⑤③
D.③②④①⑤
参考答案:B
本题解析:
本题难度:一般
3、选择题 下列各组物质中,按熔点由低到高排列的是(???? )
A.O2、I2、Hg
B.CO2、KCl、SiO2
C.Na、K、Rb
D.NaCl、KCl、RbCl
参考答案:B
本题解析:A:碘为固态,而汞为液态;C:碱金属均为金属晶体;D:离子晶体的熔点由离子键的强弱决定,而离子键的强弱由离子的半径决定,故答案为B,三者分别为分子晶体、离子晶体、原子晶体
本题难度:一般
4、选择题 下列物质按熔沸点由高到低排列的是
A.NaCl SiO2 CO2 Na
B.HI HBr HCl HF
C.NaCl KCl KBr KI
D.P4 N2 Br2 O2
参考答案:C
本题解析:二氧化硅是原子晶体,熔沸点最高,A不正确。氟化氢中含有氢键,所以熔沸点最高,B不正确。C中都是离子晶体,熔沸点和离子键强弱有关系,形成离子键的离子半径越小,电荷数越多,离子键越强,所以C正确。D中都是分子晶体,熔沸点大小和分子间作用力有关系,相对分子质量越大,分子间作用力越大,D不正确。答案选C。
本题难度:一般
5、选择题 下列晶体熔化时不需要破坏化学键的是(??? )
A.干冰
B.食盐
C.晶体硅
D.金属钾
参考答案:A
本题解析:
试题分析:分子晶体熔化时不需要破坏化学键,干冰是分子晶体,可以;食盐是离子晶体,熔化时破坏离子键;晶体硅是原子晶体,熔化时破坏共价键,金属钾是金属晶体,熔化时破坏金属键。
点评:除分子晶体外,其他晶体熔化时均破坏化学键。属于简单题。
本题难度:一般