微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (1)P4(白磷,s)+5O2(g)
参考答案:
本题解析:
本题难度:一般
2、填空题 (10分)某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中的溶质足量),当闭合该装置的电键K时,观察到电流表的指针发生了偏转。
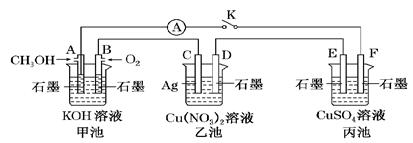
请回答下列问题:
(1)甲池为________(填“原电池”、“电解池”或“电镀池”),A电极的电极反应式为_____________。
(2)丙池中F电极为________(填“正极”、“负极”、“阴极”或“阳极”),该池总反应的化学方程式为____________________________________________________________。
(3)当乙池中C极质量减轻4.32 g时,甲池中B电极理论上消耗O2的体积为________mL(标准状况)。
(4)一段时间后,断开电键K。下列物质能使乙池恢复到反应前浓度的是________(填字母)。
A.Cu
B.CuO
C.Cu(OH)2
D.Cu2(OH)2CO3
参考答案:(1)原电池(1分) CH3OH+8OH--6e-===CO
本题解析:
试题分析:(1)从图可以看出甲是一个甲醇燃料电池,燃料电池是原电池,在燃料电池中燃料反应的一极是负极,氧气反应的一极是正极,所以A是负极、B是正极,由于电解质溶液是KOH溶液,所以甲醇反应生成的CO2不能以气体的形式释放出去,而是与OH-反应生成CO32-,则A电极反应方程式为:2CH3OH+16OH--12e-="==2" CO32-+12H2O。(2)甲是原电池,那么乙和丙都是池为电解池,丙中F接原电池的负极,作阴极,丙池中就是用惰性材料电解CuSO4溶液,电池的总反应为:2CuSO4+2H2O===2H2SO4+2Cu+O2↑。(3)乙池中C接电源的正极,作为阳极,Ag是活性材料,所以是Ag放电,电极反应为:Ag- e-=Ag+,C极质量减轻4.32g,则反应的Ag的物质的量为:4.32g÷108g/mol=0.04mol,根据反应知道反应0.04molAg时转移的电子为0.04mol,再根据B电极反应式为:O2+4e-+ 2H2O=4OH-,转移0.04mol电子时反应的O2的物质的量为0.01mol,O2体积为0.01 mol×22.4L/mol=0.224L=224mL。(4)电解时乙池中C的电极反应为:Ag- e-=Ag+,D的电极反应为Cu2++2e-=Cu,可以看出溶液中多了Ag+,少了Cu2+,要恢复反应前的浓度可以加入Cu,将其中的Ag+置换出来即可,选A。
考点:原电池和电解池的判断、原电池和电解池的工作原理、电极反应的书写、电子转移的计算等。
本题难度:困难
3、选择题 将Mg条、Al条平行插入一定浓度的NaOH溶液中(如图所示连接)。此电池工作时,下列叙述正确的是
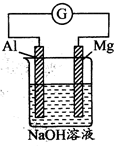
A.Mg比Al活泼,失去电子被氧化成Mg2+
B.Al条在反应中逐渐变细
C.该电池的外电路中,电子由Mg极流出,Al极流入
D.消耗24gMg,电路中将转移2mol电子
参考答案:B
本题解析:
试题分析:A、在NaOH溶液中,铝能与NaOH溶液发生氧化还原反应,在该反应中,铝失电子作原电池的负极,而金属镁作原电池的正极,错误;B、Al条在反应中逐渐变细,正确;C、该装置的外电路,电子由铝极流出,镁极流入,错误;D、镁作正极,不消耗,选B。
考点:考查原电池的工作原理。
本题难度:一般
4、选择题 将两个铂电极放置在KOH溶液中,然后分别向两极通入CH4和O2,即可产生电流。下列叙述正确的是
①通入CH4的电极为正极 ②正极的电极反应式为O2+2H2O+4e-=4OH- ③通入CH4的电极反应式为CH4+2O2+4e-=CO2+2H2O ④负极的电极反应式为CH4+10OH--8e-=CO32-+7H2O ⑤放电时溶液中的阳离子向负极移动 ⑥放电时溶液中的阴离子向负极移动
A.①③⑤
B.②④⑥
C.④⑤⑥
D.①②③
参考答案:B
本题解析:根据题意知发生的反应为CH4+2O2=CO2+2H2O,反应产生的CO2在KOH溶液中会转化为CO32-。CH4为还原剂,应通入电源的负极,所以①错误;正极的电极反应式为O2+2H2O+4e-=4OH-,故②④正确,③错误;放电时溶液(原电池内电路)中的阳离子向正极移动,阴离子向负极移动,⑤错误,⑥正确。答案选B。
本题难度:一般
5、选择题 液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点。一种以肼(N2H4)为燃料的电池装置如图所示。该电池用空气中的氧气作为氧化剂,KOH作为电解质。下列关于该燃料电池的叙述不正确的是
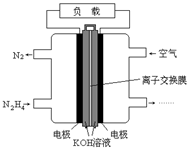
A.电流从右侧电极经过负载后流向左侧电极
B.负极发生的电极反应式为:N2H4 + 4OH- - 4e - = N2+ 4H2O
C.该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触
D.该燃料电池持续放电时,正极发生氧化反应,PH减小
参考答案:D
本题解析:
试题分析:燃料电池通入燃料的一极为负极。电流有正极流向负极,A正确;负极反应是N2H4,环境是碱性,产物是N2,故B正确;C项电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触,是正确的。总反应为N2H4 + O2 ="=" N2+ 4H2O,产生水,使KOH溶液浓度降低pH减小,D正确。
本题难度:一般