微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知某氢氧化物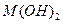 的溶度积常数为
的溶度积常数为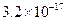 ,则
,则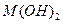 在水中的溶解度为:
在水中的溶解度为:
A.
B.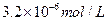
C.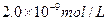
D.
参考答案:A
本题解析:略
本题难度:简单
2、选择题 在一定温度下,可逆反应A2(g)+B2(g)?

2AB(g)达到平衡的标志是( )
A.A2、B2、AB的浓度不再变化
B.容器中的压强不再随时间变化而变化
C.A2、B2、AB的浓度之比为1:1:2
D.单位时间内生成nmol的A2同时生成2nmol的AB
参考答案:A、容器内各组分的浓度不随时间的变化而变化,就说明了该反应达
本题解析:
本题难度:一般
3、选择题 下列图像及对应说法正确的是(????)
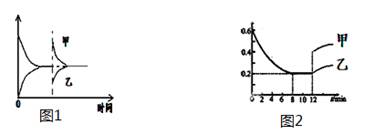
A.图1表示恒温恒压下条件,向2HI  H2 + I2 ΔH>0的反应达到平衡的容器中充入HI,甲表示正反应速率,乙表示逆反应速率
H2 + I2 ΔH>0的反应达到平衡的容器中充入HI,甲表示正反应速率,乙表示逆反应速率
B.图1表示恒容下条件,向2HI  H2 + I2 ΔH>0的 反应达到平衡的容器加热,甲表示正反应速率,乙表示逆反应速率
H2 + I2 ΔH>0的 反应达到平衡的容器加热,甲表示正反应速率,乙表示逆反应速率
C.图2表示恒温条件下,压缩2SO3(g) 2SO2(g)+O2(g) ΔH>0平衡反应体系,甲表示的SO3物质的量的变化,乙表示的SO3物质的量浓度的变化
2SO2(g)+O2(g) ΔH>0平衡反应体系,甲表示的SO3物质的量的变化,乙表示的SO3物质的量浓度的变化
D.图2表示恒容条件下,对于2SO3(g) 2SO2(g)+O2(g) ΔH>0反应平衡体系,甲表示升高温度SO3物质的量的变化,乙表示增加O2后SO3物质的量变化
2SO2(g)+O2(g) ΔH>0反应平衡体系,甲表示升高温度SO3物质的量的变化,乙表示增加O2后SO3物质的量变化
参考答案:A
本题解析:
试题分析:恒温恒压下条件,向2HI  H2 + I2 ?ΔH>0的反应达到平衡的容器中充入HI,容器中气体是物质的量增大,容器的容积扩大,由于HI的含量、浓度增大,所以正反应速率增大,因为生成物的浓度在改变的一瞬间,由于容器的容积扩大导致浓度减小,所以逆反应速率降低。因此该说法正确。B. 升高温度,
H2 + I2 ?ΔH>0的反应达到平衡的容器中充入HI,容器中气体是物质的量增大,容器的容积扩大,由于HI的含量、浓度增大,所以正反应速率增大,因为生成物的浓度在改变的一瞬间,由于容器的容积扩大导致浓度减小,所以逆反应速率降低。因此该说法正确。B. 升高温度,
本题难度:一般
4、选择题 在恒温、恒容的条件下,有反应2A(g)+2B(g) C(g)+3D(g),现从两条途径分别建立平衡。途径I:A、B的起始浓度为2mol·L—1;途径II:C、D的起始浓度分别为2mol·L—和6mol·L—;则以下叙述正确的是????????????????????????????????(???)
C(g)+3D(g),现从两条途径分别建立平衡。途径I:A、B的起始浓度为2mol·L—1;途径II:C、D的起始浓度分别为2mol·L—和6mol·L—;则以下叙述正确的是????????????????????????????????(???)
A.两途径最终到平衡时,体系内混合气的百分组成相同
B.两途径最终达到平衡时,体系内混合气的百分组成不同
C.达平衡时,途径I的反应速率v(A)等于途径II的反应速率v(A)
D.达平衡时,途径I所得混合气的密度为途径II所得混合气密度的1/2
参考答案:AD
本题解析:按照等效平衡的思想,途径I和途径II的物质起始浓度都满足系数之比,又在恒温、恒容的条件下进行,所以最终到平衡时,体系内混合气的百分组成相同;由于起始的浓度不一样,所以达平衡时,途径I的反应速率v(A)不等于途径II的反应速率v(A);途径I时物质浓度是途径II的1/2,故达平衡时,途径I所得混合气的密度为途径II所得混合气密度的1/2。
本题难度:简单
5、选择题 若过程I与过程II温度相同,则关于反应N2O4(g) 2NO2 (g)在下列过程中发生的变化描述正确的是
2NO2 (g)在下列过程中发生的变化描述正确的是
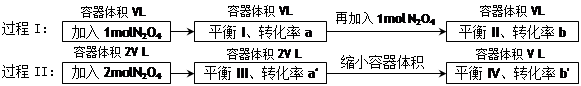
A.a" < b"、a > b
B.在平衡I向平衡II过渡的过程中,v(逆) < v(正)
C.a" > a、b" < b
D.平衡II与平衡IV中N2O4的质量分数相等
参考答案:D
本题解析:平衡II与平衡IV温度相同,容器体积都为V L,且都含有2molN2O4,平衡II与平衡IV中N2O4的质量分数相等,选择D。
本题难度:简单