微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 可逆反应达到平衡的标志是正反应速率与逆反应速率相等反应就停止了.______.
参考答案:可逆反应达到平衡状态时,正逆反应速率相等但不等于零,它是一个
本题解析:
本题难度:一般
2、选择题 利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍。
反应一:Ni(粗,s)+4CO(g)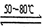 Ni(CO)4(g)?? ΔH < 0
Ni(CO)4(g)?? ΔH < 0
反应二:Ni(CO)4(g)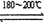 Ni(纯,s)+4CO(g)???? ΔH > 0
Ni(纯,s)+4CO(g)???? ΔH > 0
下列说法错误的是
A.对于反应一,适当增大压强,有利于Ni(CO)4的生成
B.提纯过程中,CO气体可循环使用
C.升高温度,反应一的反应速率减小,反应二的速率增大
D.对反应二,在180—200℃,温度越高,Ni(CO)4(g)的转化率越高
参考答案:C
本题解析:
试题分析:A、增大压强,反应一平衡向右移动,正确;B、反应一CO作反应物。反应二生成了CO,所以CO气体可循环使用,正确;C、升高温度,所有化学反应的速率都增大,错误;D、反应二为吸热反应,温度升高,平衡向右移动,正确。
本题难度:一般
3、填空题 10000C时,硫酸钠可与氢气发生反应: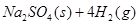

 。请回答下列问题:
。请回答下列问题:
(1)上述反应的平衡常数表达式为:???????????????????????????。
(2)上述反应在三个不同条件下进行,其中H2的浓度随时间的变化如图所示。

①与曲线a比较,b和c分别仅改变一种反应条件,则曲线b改变的条件为?????????
②该反应的△H___0(填“>”、“<”或“=”),其判断理由是????????????????????????。
(3)该温度下,向2L盛有1.42g Na2SO4的密闭容器中通入H2,5min后测得
固体质量为1.10g。则该时间范围内的平均反应速率v(H2)= ?????????。
(4)能说明该反应已达到平衡状态的是 ???????(填字母,下同)。
a.容器内压强保持不变
b.容器内气体密度保持不变
c.c(H2)=c(H2O)d.v正(H2)=v逆(H2O)
参考答案:(1)c4(H2O)/c4(H2)? (2分)
(2)
本题解析:
试题分析:(1)根据题给化学方程式结合平衡常数表达式的书写原则写出上述反应的平衡常数表达式为:c4(H2O)/c4(H2);(2)①根据题给图像分析,与曲线a比较,曲线b缩短了达平衡的时间,氢气的平衡浓度未发生变化,则曲线b改变的条件为使用催化剂;②与曲线a比较,曲线c缩短了达平衡的时间,氢气的平衡浓度减小,则曲线c改变的条件为升高温度; 温度升高,达平衡时间缩短,平衡时H2浓度减少,说明升高温度平衡向正反应方向移动。该反应的△H>0;(3)该温度下,向2L盛有1.42g Na2SO4的密闭容器中
本题难度:简单
4、选择题 一定温度下,在2 L密闭容器中加入纳米级Cu2O并通入0.1 mol H2O(g),发生反应:2H2O(g)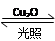 2H2(g)+O2(g) ΔH=+484 kJ·mol-1,不同时间产生O2的物质的量见下表:
2H2(g)+O2(g) ΔH=+484 kJ·mol-1,不同时间产生O2的物质的量见下表:
时间/min
| 20
| 40
| 60
| 80
|
n(O2)/mol
| 0.001 0
| 0.001 6
| 0.002 0
| 0.002 0
?
下列说法不正确的是????? ( )。
A.前20 min内的平均反应速率v(H2O)=5.0×10-5 mol·L-1·min-1
B.达到平衡时,至少需要从外界吸收能量0.968 kJ
C.增大c(H2O),可以提高水的分解率
D.催化效果与Cu2O颗粒的大小有关
参考答案:C
本题解析:由题意知,v(H2O)=2v(O2)= =5.0×10-5 mol·L-1 =5.0×10-5 mol·L-1
·min-1,A正确。热化学方程式表示的含义是2 mol H2O(g)完全分解生成2 mol H2(g)和1 mol O2(g),吸收484 kJ的能量,所以生成O2 0.002 0 mol时,吸收的能量为0.002 0 mol×4
本题难度:一般
5、选择题 工业生产硫酸过程中的一步反应是2SO2(g)+O2(g)?2SO3(g).如果该反应在密闭容器内进行,能说明该反应达到化学平衡状态的是( )
A.SO2完全转化为SO3
B.消耗2molSO2的同时生成2molSO3
C.SO2、O2与SO3的物质的量之比为2:1:2
D.SO2、O2与SO3的浓度不再随时间变化
参考答案:A.可逆反应,反应物不能完全转化,故A错误;
B.消耗
本题解析:
本题难度:简单
|