微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 SO2是硫酸工业尾气的主要成分。实验室中,拟用如图所示流程,测定标准状况下体积为V L的硫酸工业尾气中SO2的含量。
过量H2O2溶液步骤①过量Ba(OH)2溶液步骤②步骤③
(1)步骤①中加入H2O2溶液时发生反应的离子方程式为____________________,1 mol H2O2参加反应,转移的电子数为________。
(2)步骤③的操作依次是过滤、________、________、称重。
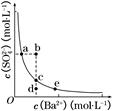
(3)一定温度下,BaSO4的沉淀溶解平衡曲线如图所示。步骤②逐滴加入Ba(OH)2溶液的过程中,BaSO4的溶度积常数________(填“增大”、“减小”或“不变”),溶液中SO42-浓度的变化情况为________(填序号)。
①d→c→e???????②b→c→d?????③a→c→e????④d→c→a
(4)该V L尾气中SO2的体积分数为________(用含有V、m的代数式表示)。
参考答案:(1)H2O2+SO2=2H++SO42- 1.204×10
本题解析:(1)H2O2具有氧化性,能与SO2发生氧化还原反应,离子方程式为H2O2+SO2=2H++SO42-,1 mol H2O2参加反应,转移2 mol电子。
(2)步骤③将沉淀过滤洗涤、干燥后称重。
(3)在滴加Ba(OH)2溶液的过程中,溶液的温度不变,Ksp不变,BaSO4在溶液中存在沉淀溶解平衡:BaSO4(s)??Ba2+(aq)+SO42- (aq),加入Ba(OH)2溶液后,c(Ba2+)增大,但Ksp=c(Ba2+)·c(SO42-)不变,故c(SO42-)逐渐减小。由于温度不变,
本题难度:一般
2、选择题 在溶液中有浓度均为0.0lmol/L的Fe3+、Cr3+、Zn2+、Mg2+等离子,已知:
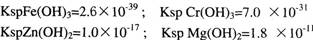
当氢氧化物开始沉淀时,下列哪一种离子所需的pH最小(??? )
A.Fe3+
B.Cr3+
C.Zn2+
D.Mg2+
参考答案:A
本题解析:略
本题难度:简单
3、选择题 下列说法中正确的是?????????? ( )
A.饱和石灰水中加入一定量生石灰,温度明显升高,所得溶液的pH增大
B.AgCl悬浊液中存在平衡:AgCl(s) Ag+(aq)+Cl-(aq),往其中加入少量NaCl粉末,平衡向左移动,溶液中离子的总浓度会减小
Ag+(aq)+Cl-(aq),往其中加入少量NaCl粉末,平衡向左移动,溶液中离子的总浓度会减小
C.AgCl悬浊液中加入KI溶液,白色沉淀变成黄色,证明此条件下Ksp(AgCl)>Ksp(AgI)
D.硬水中含有较多的 Ca2+、Mg2+、HCO3—、SO42—,加热煮沸可以完全除去其中的Ca2+、Mg2+
参考答案:C
本题解析:A项中Ca(OH)2的溶解度随温度的升高而降低,溶液中c(OH-)减小,故所得溶液的pH减小,A错误;B项中加入NaCl,增大了Cl-的浓度,平衡左移,同时Na+的浓度增大,因此溶液中离子的总浓度不会减小,B错误;根据沉淀的转化理论可知,C正确;加热煮沸只能使部分Ca2+、Mg2+除去,但不可能完全除去,D错误。
本题难度:一般
4、选择题 当固体AgCl放在较浓的KI溶液中振荡时,部分AgCl转化为AgI,其原因是.(???)
A.AgI比AgCl稳定
B.氯的非金属性比碘强
C.I-的还原性比Cl-强
D.AgI的溶解度比AgCl小
参考答案:D
本题解析:
试题分析:由于沉淀转化的方向一般是向生成更难溶的方向进行,所以根据部分AgCl转化为AgI可知,碘化银的溶解度小于氯化银的溶解度,因此答案选D。
点评:沉淀转化的实质实际上是溶解平衡的应用,即由于改变了某离子的浓度,破坏了溶解平衡,从而达到新的平衡状态。利用溶解平衡,可以使反应向我们希望的方向进行。
本题难度:一般
5、选择题 下列说法正确的是
A.在一定温度下的AgCl水溶液中,Ag+和Cl-浓度的乘积是一个常数
B.AgCl的Ksp=1.8×10-10 mol2·L-2,在任何含AgCl固体的溶液中,[Ag+]=[Cl-],且Ag+和Cl-浓度的乘积等于1.8×10-10mol2·L-2
C.温度一定时,在AgCl饱和溶液中,Ag+和Cl-浓度的乘积是一个常数
D.向饱和AgCl溶液中加入盐酸,Ksp变大
参考答案:C
本题解析:
试题分析:A.在AgCl的饱和溶液中,Ksp=c(Cl-)·c(Ag+),若为不饱和溶液,Ksp>c(Cl-)·c(Ag+),错误; B.AgCl难溶,但溶于水的AgCl完全电离,AgCl是强电解质,错误;在AgCl的饱和溶液中,Ksp=c(Cl-)·c(Ag+),C正确;D.Ksp只与温度有关,温度不变,Ksp不变,错误。
考点:考查溶度积常数。
本题难度:一般