微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知硫酸亚铁溶液中加入过氧化钠时发生反应:4Fe2++4Na2O2+6H2O=4Fe(OH)3↓+O2↑+8Na+,则下列说法正确的是 ( )
A.该反应中Fe2+是还原剂,O2是还原产物
B.4 mol Na2O2在反应中共得到8NA个电子
C.Fe(OH)3是氧化产物,每生成1 mol O2反应过程中共转移6 mol电子
D.反应过程中可以看到白色沉淀转化为灰绿色再转化为红褐色沉淀
参考答案:C
本题解析:
试题分析:A.该反应中Fe2+中元素的化合价升高,失去电子,所以Fe2+是还原剂,而Na2O2中O元素的化合价部分升高,失去电子;部分降低,得到电子,O2是Na2O2失去电子后形成的物质,是氧化产物,错误;B.4 mol Na2O2在反应中共得到6NA个电子,错误;C.Fe(OH)3是Fe2+失去电子后形成的氧化产物,每生成1 mol O2反应过程中共转移6 mol电子,正确;D.由于其中含有氧化剂,所以反应过程中产生的沉淀就是红褐色,不会看到白色沉淀转化为灰绿色再转化为红褐色沉淀的过程,错误。
考点:考查氧化还原反应中概念、电子转移、实验现象的关系的知识。
本题难度:一般
2、选择题 下列说法正确的是(?????)
A.凡是同种分子构成的物质都是纯净物
B.含有氧元素的化合物是氧化物
C.同种元素组成的物质一定是单质
D.质子数相同的微粒,一定属于同种元素
参考答案:A
本题解析:略
本题难度:简单
3、选择题 常温常压下,下列5种气体各取1mol,分别在足量的氧气中燃烧,消耗氧气最多的是( )
A.甲烷
B.乙烯
C.乙炔
D.丙烷
参考答案:根据CxHy+(x+
本题解析:
本题难度:简单
4、选择题 & nbsp;铁粉和铜粉的均匀混合物平均分成四等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成NO的体积和剩余金属的质量如下表(设硝酸的还原产物只有NO):
编号
| ①
| ②
| ③
| ④
|
稀硝酸体积/mL
| 100
| 200
| 300
| 400
|
剩余金属/g
| 18.0
| 9.6
| 0
| 0
|
NO体积/mL
| 2240
| 4480
| 6720
| V
下列计算结果正确的是 ( )
A.①中溶解了5.6gFe B.硝酸的浓度为0.4mol/L
C.②中溶解了9.6gCu D.④中V=8960
参考答案:D
本题解析:
试题分析:根据题给数据可知,实验①、②都有金属剩余,则反应后的溶液中不可能含有硝酸铁,溶液中金属离子为亚铁离子和铜离子,实验②是在实验①的基础上加入100mL硝酸,参加反应的金属的质量为8.4g,生成NO的体积为2240mL,物质的量为0.1mol,根据电子转移守恒可知,参加反应金属的物质的量为0.1mol×(5—2)/2=0.15mol,参加反应金属的摩尔质量为56g/mol,该过程只有Fe参加反应,故实验①只有Fe参与反应,根据NO的体积结合方程式计算参加反应Fe的物质的量、硝酸的物质的量,根据m=nM计算参加反应Fe的质量,根据c=nV计算硝酸的物质的量浓度;在实验②的基础上加入100mL硝酸,参加反应的金属的质量为9.6g,生成NO的体积为2240mL,物质的量为0.1mol,若该过程只有Cu参加反应,根据电子转移守恒,则Cu的物质的量0.15mol,Cu的质量9.6g,等于参加反应金属的质量,故该过程只有Cu反应,且Cu恰好完全反应,则加入200mL硝酸时,Fe恰好反应生成硝酸亚铁,在实验③的基础上再加入100mL硝酸,硝酸与溶液中亚铁离子反应生成NO,根据亚铁离子的物质的量,利用电子转移守恒计算该阶段生成NO的物质的量,再根据V=nVm计算该阶段生成NO的体积,进而计算V的值。A、根据上述分析可知,实验①发生反应3Fe+8HNO3
本题难度:一般
5、选择题 下列化学用语表示正确的是(???)
A.食盐中阴离子的结构示意图为: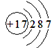
B.硫酸氢钠溶液的电离方程式:NaHSO4=Na++H++SO42-
C.三氟化氮的电子式: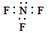
D.乙醇分子比例模型: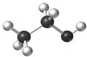
参考答案:B
本题解析:
试题分析:氯离子的最外层电子数是8个,A不正确;C不正确,因为F原子还有6个电子没有参与成键,电子式应该是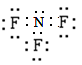 ;D不正确,所给模型应该是球棍模型,所以正确的答案选B。 ;D不正确,所给模型应该是球棍模型,所以正确的答案选B。
本题难度:一般
|