微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在一定的温度和压强下,1体积X2(气)跟3体积Y2(气)化合生成2体积化合物(气),则该化合物的化学式是( )。
A.XY3
B.XY
C.X3Y
D.X2Y3
参考答案:A
本题解析:根据阿伏加德罗定律和质量守恒定律分析。
本题难度:简单
2、选择题 下列有关化学用语表达不正确的是
A.钙离子的电子式:Ca2+
B.CO2分子的结构式:O=C=O
C.Na的原子结构示意图: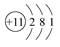
D.氮气的电子式:∶N∶∶∶N∶
参考答案:D
本题解析:
试题分析:D.氮气的电子式: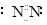 ?,所以D错误。
?,所以D错误。
点评:考查化学用语表达,属于基础题,平时注意积累即可解答。
本题难度:简单
3、填空题 化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求。某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好。(e处反应的化学方程式为:2KMnO4+16HCl===2MnCl2+5Cl2↑+8H2O)
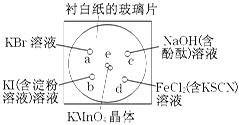
(1)e处反应中被氧化的HCl与参加反应的HCl的物质的量之比为 。
(2)b处的实验现象为___________________________________。
(3)c处反应的化学方程式为_____________________________________,标准状况下,当有0.224 L Cl2被NaOH溶液吸收后,转移电子的物质的量为 mol。
(4)通过该实验比较Cl2、FeCl3、KMnO4三种物质氧化性由强到弱的顺序是 。
参考答案:(1) 5∶8;(2)溶液由无色变为蓝色;(3)Cl2+2N
本题解析:
试题分析:(1)在e处KMnO4与浓盐酸发生反应产生氯气,反应的方程式是2KMnO4+16HCl===2MnCl2+5Cl2↑+8H2O。在该反应中,16mol的HCl参加反应,有10魔力岛HCl中的Cl化合价升高失去,电子,被氧化变为氯气;有6mol的HCl仍然是以-1价的Cl存在,表现出酸性,与金属阳离子结合形成盐,所以反应中被氧化的HCl与参加反应的HCl的物质的量之比为10:16=5:8;(2)产生的氯气与KI淀粉溶液发生反应:Cl2+2KI===2KCl+I2 ,产生的I2 遇淀粉,溶液变为蓝色,因此b处的实验现象为溶液由无色变为蓝色;(3)c处氯气与碱发生歧化反应,反应的化学方程式为Cl2+2NaOH===NaCl+NaClO+H2O;根据方程式可知:每有1mol的氯气被吸收,转移1mol的电子,标准状况下,当有0.224 L Cl2被NaOH溶液吸收后,由于氯气的物质的量是0.01mol,所以转移电子的物质的量为0.01mol。(4)在氧化还原反应中,氧化性:氧化剂大于氧化产物。根据方程式2KMnO4+16HCl===2MnCl2+5Cl2↑+8H2O可知,氧化性:KMnO4>Cl2;根据反应:Cl2+FeCl2= FeCl3可知氧化性:Cl2>FeCl3 。所以该实验比较三种物质氧化性由强到弱的顺序是KMnO4>Cl2>FeCl3 。
考点:考查微型化学实验在物质的反应中氧化性强弱比较、反应现象、电子转移、气体吸收的作用的知识。
本题难度:一般
4、选择题 有关氧化还原反应的下列说法正确的是
A.一种元素被氧化,肯定有另一种元素被还原
B.反应中转移电子的数目等于得电子总数与失电子总数之和
C.氧化剂中的元素化合价不一定都降低
D.氧化剂具有氧化性,发生氧化反应
参考答案:C
本题解析:
试题分析:A、在氧化还原反应中也可以是同一种元素之间发生氧化还原反应,例如氯气与氢氧化钠溶液的反应,A不正确;B、反应中转移电子的数目等于得电子总数或失电子总数,B不正确;C、物质所含元素化合价降低的是氧化剂,但氧化剂中的元素化合价不一定都降低,C正确;D、.氧化剂具有氧化性,发生还原反应,D不正确,答案选C。
本题难度:一般
5、选择题 自然界中存在的元素大多以化合态存在,而我们在生产和生活中需要许多单质,如金属铁、单晶硅等。试想,如果把某元素由化合态变为游离态,则该元素
A.被氧化
B.有可能被氧化,也有可能被还原
C.被还原
D.该元素既不被氧化也不被还原
参考答案:B
本题解析:元素由化合态变为游离态,可能是失去电子,比如:Cl2+2KBr=2KCl+Br2
也可能是得到电子,比如:Fe+CuCl2=FeCl2+Cu。所以有可能是被氧化,也有可能被还原。答案选B。
本题难度:简单