微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 铁和氧化铁的混合物共a mol,加盐酸后固体全部溶解,共收集到氢气2bg,且向反应后的溶液中加人KSCN溶液,不显红色,则原混合物中氧化铁的物质的量为
A. ??? B (a — b) mol
??? B (a — b) mol
C ???D. (a+b) mol
???D. (a+b) mol
参考答案:C
本题解析:本题铁及化合物的计算。根据题意知:Fe和Fe2O3的混合物与盐酸反应再加入KSCN不显红色,这说明无Fe3+,且放出H2 bmol。所发生的反应方程式为: Fe2O3+6HCl 2FeCl3+3H2O①Fe+2HCl
2FeCl3+3H2O①Fe+2HCl 本题难度:一般
本题难度:一般
2、实验题 人教版《必修1》关于Fe3+和Fe2+的转化的实验探究,某校教师为了检验学生完成每个实验过程时相应的问题解决思路,特设计一份化学探究学习“过程-思路”问卷。
(1)请在下表中右栏填写设计每一步操作过程的思路
过程
| 思路
|
1.提出假设:Fe2+具有还原性,可以被氧化成Fe3+;Fe3+具有氧化性,可以被还原成Fe2+
| ①根据氧化还原反应原理,一般?????物质有还原性,????????物质有氧化性
|
2.设计实验1:取少量FeCl2溶液,滴加几滴H2O2溶液,再向溶液中滴加几滴KSCN溶液,观察溶液是否变血红色
| ②用离子方程式表示选择H2O2的原因?????
③用离子方程式表示溶液变血红色的原因???
|
3.设计实验2:取少量FeCl3固体于一试管,用已煮沸的蒸馏水溶解,滴加几滴KSCN溶液后迅速加入少量铁粉,盖上试管塞,观察溶液的血红色是否褪去
| ④选择铁粉的原因是??????????(用化学方程式表示)
⑤为什么要用煮沸的水?????????????????
|
4.实施实验
| ……
|
……
| ……
?
(2)教材中实验方案如下:取2mLFeCl3溶液,加入少量铁粉,充分反应后,滴入几滴KSCN溶液,观察并记录实验现象。把上层清液倒入另一试管中,再滴入几滴氯水,又发生了什么变化?学生通过实践证明,实验效果很差:没有预期的红色出现,而是很淡的浅红色,试分析实验中出现异常的可能原因并加以改进使实验现象更明显。
⑥可能的原因:????????????????????????????????????????????????????????????
⑦改进措施:??????????????????????????????????????????????????????????????
参考答案:
(1)①低价(态)??高价(态) (1+1=2分)
本题解析:实验探究题(1)①根据所给出的离子,从化合价的角度分析氧化还原性,低价物质具有还原性,高价物质具有氧化性;②加入双氧水具有氧化性把Fe2+氧化成Fe3+④铁粉用来还原Fe3+转化为Fe2+;⑤除去溶液中溶解的气体一般采用加热的方法,因为温度高气体溶解度降低;(2)溶液颜色没有出现红色,原因可能是Fe3+ 和SCN-缺少一种,溶液中氯水能氧化出Fe3+ ?,所以结果只有一种可能就是SCN-被氧化。为了避免SCN-氧化,应先加入氯水后,在加入KSCN溶液,具体操作应为取适量FeCl3溶液,加入足量铁粉,然后将
本题难度:一般
3、选择题 将5.6g铁溶于足量稀盐酸中,再加入足量的氢氧化钠溶液,充分反应,过滤;在空气中加热所得滤渣,灼烧到质量不再变化,此时固体的质量为
A.7.2g
B.8.0g
C.9.0g
D.10.7g
参考答案:B
本题解析:
试题分析:5.6g铁的物质的量是5.6g÷556g/mol=0.1mol。铁与盐酸反应生成氯化亚铁和氢气,加热足量的氢氧化钠溶液后生成氢氧化亚铁白色沉淀。氢氧化亚铁不稳定,最终被转化为氢氧化铁。氢氧化铁受热分解生成氧化铁和水,所以根据铁原子守恒可知氧化铁的物质的量是0.1mol÷2=0.05mol,质量=0.05mol×160g/mol=8.0g,答案选B。
本题难度:一般
4、选择题 下列关于铁及其化合物的说法中正确的是
A.Fe3O4是—种红棕色粉末,俗称磁性氧化铁
B.铁与水蒸气在高温下的反应产物为Fe2O3和H2
C.去除FeCl2溶液中的FeCl3杂质可以向溶液中加入过量铁粉,然后过滤
D.Fe3+与KSCN反应产生红色沉淀
参考答案:C
本题解析:
试题分析:A. Fe3O4是—种黑色晶体,俗称磁性氧化铁。? B.铁与水蒸气在高温下的反应产物为Fe3O4和H2。D.Fe3+与KSCN反应产生红色溶液;所以,ABD错误。
本题难度:一般
5、填空题 目前,铁是使用最广泛的金属之一,已知在高温下,Fe与水蒸气可发生反应。?
应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。
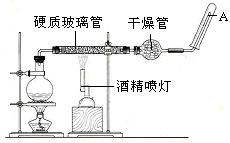
请回答下列的问题。
铁在周期表中的位置是_______
请写出该反应的化学方程式:???????????????????????????????????????;
(3)曾利用铝和铁的氧化物反应原理来焊接钢轨,该反应的化学方程式为?????????????
(4)现有铁和铂组成的合金共a mol,其中Pt的物质的量分数为x,研成粉末状后全部投入含bmol HNO3的稀溶液中,使其充分反应,且HNO3的还原产物只有NO。试回答下列问题:
①随HNO3用量的增加,溶液中的金属离子和残留固体的成分依次有四种情况,请用粒子符号填写下表空白:
?
| ①
| ②
| ③
| ④
| 溶液中的金属离子
| ?
| Fe2+
| ?
| ?
| 残留固体成分
| Fe、Pt
| ?
| Pt
| Pt
?
②当x="0.5" ,且溶液中Fe3+与Fe2+和物质的量相等,在标准状况下共产生112mLNO。
则a =??????????,b =?????????????,
参考答案:(1)第四周期,第Ⅷ 族????? (1分)
(2)3
本题解析:
试题分析:(1)Fe在元素周期表中位于第四周期,第Ⅷ 族。
(2)Fe与H2O(g)反应生成Fe3O4和H2,化学方程式为:3Fe+4H2O(g)  Fe3O4+4H2 Fe3O4+4H2
(3)铝和铁的氧化物反应原理来焊接钢轨,化学方程式为:2Al+Fe2O 3 本题难度:一般 本题难度:一般
|
|