微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (6分)化合物SOCl2是—种液态化合物,沸点为77℃。在盛有10mL水的锥形瓶中,小心地滴加8滴~10滴SOC12,可观察到剧烈反应,液面上有白雾形成,并有带刺激性气味的气体逸出。该气体可使滴有品红试液的滤纸褪色。轻轻振荡锥形瓶,等白雾消失后,往溶液中滴加AgNO3溶液,有不溶于HNO3的白色凝乳状沉淀析出。
(1)根据上述实验,写出SOCl2和水反应的化学方程式:_________________________
(2)AlCl3溶液蒸干灼烧得不到无水AlCl3,而用SOCl2与AlCl3·6H2O混合共热,可得到无水AlCl3,其原因是_________________________________________________。
参考答案:(1)SOCl2 + H2O = SO2 + 2HCl
本题解析:
试题分析:(1)将SOCl2滴到水中,产生能是品红褪色的刺激性气味的气体,则该气体是SO2,得到的溶液加AgNO3溶液产生不溶于HNO3的白色沉淀,说明溶液中有Cl-,所以SOCl2与水反应的化学方程式为:SOCl2 + H2O = SO2 + 2HCl。
(2)AlCl3+3H2O Al(OH)3
Al(OH)3
本题难度:一般
2、选择题 有下列四种溶液:①盐酸;②氯化铁;③氢氧化钠;④碳酸钠。它们的pH分别为4,4,10,10,溶液中水的电离度为α1,α2,α3,α4,则下列关系正确的是
A.α1=α2>α3=α4
B.α2=α4>α1=α3
C.α1=α2=α3=α4
D.α1=α3>α2=α4
参考答案:B
本题解析:反应H2O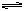 H++OH--Q;①向水中加入酸或碱,[H+]或[OH-]增大,平衡向左移动,抑制了水的电离,αH2O减小;②向水中加入能水解的盐,消耗H+或OH-,使平衡向右移动,促进水的电离,αH2O增大;③升高温度,平衡向右移动,αH2O增大;④向水中加入其他能与H+或OH-反应的物质,也能促进水的电离。如Na
H++OH--Q;①向水中加入酸或碱,[H+]或[OH-]增大,平衡向左移动,抑制了水的电离,αH2O减小;②向水中加入能水解的盐,消耗H+或OH-,使平衡向右移动,促进水的电离,αH2O增大;③升高温度,平衡向右移动,αH2O增大;④向水中加入其他能与H+或OH-反应的物质,也能促进水的电离。如Na
本题难度:一般
3、选择题 已知酸H2B在水溶液中存在下列关系:①H2B = H++HB—,②HB—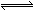 H++B2—,则下列说法中一定正确的是
H++B2—,则下列说法中一定正确的是
A.NaHB溶液一定呈酸性,Na2B溶液一定呈碱性
B.Na2B溶液一定呈碱性,NaHB溶液可能呈酸性也可能呈碱性
C.NaHB水溶液中一定有:c(Na )+c(H
)+c(H )=c(HB
)=c(HB )+c(OH
)+c(OH )+c(B
)+c(B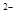 )
)
D.在Na2B溶液中一定有:c(OH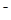 )=c(H
)=c(H )+c(HB
)+c(HB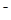 )
)
参考答案:AD
本题解析:
正确答案:AD
A.正确,NaHB不水解,溶液一定呈酸性,Na2B水解,溶液一定呈碱性
B.不正确;
C.不正确,NaHB水溶液中一定有:电荷守恒应为c(Na )+c(H
)+c(H 本题难度:一般
本题难度:一般
4、选择题 等体积的下列溶液中,阳离子总数最多的是()
A.0.1mol·L-1的FeCl3溶液
B.0.1mol·L-1的AlCl3溶液
C.0.05mol·L-1的Na2S溶液
D.0.05mol·L-1的Al2(SO4)3溶液
参考答案:A
本题解析:Fe3+、Al3+水解,每1molFe3+、Al3+水解可产生3molH+,Fe3+的水解能力比Al3+强,所以0.1mol·L-1的FeCl3中阳离子最多。
本题难度:简单
5、选择题 常温下,pH=11的氨水和pH=1的盐酸等体积混合后(不考虑溶液体积的变化),恰好完全反应。下列说法不正确的是
A.原氨水物质的量浓度为0.1mol·L-1
B.反应后的溶液中c(NH+4)+c(NH3·H2O)+c(NH3)=0.1mol·L-1
C.反应后的溶液中:c(Cl-)>c(NH+4)>c(H+)>c(OH-)
D.原氨水中:c(NH+4)+c(H+)=c(OH-)
参考答案:B
本题解析:略
本题难度:一般