微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 设nA为阿伏加德罗常数的数值,下列说法正确的是
( )
A.常温常压下,8 g O2含有4nA个电子
B.1 L 0.1 mol·L-1的氨水中有nA个NH4+
C.标准状况下,22.4 L盐酸含有nA个HCl分子
D.1 mol Na被完全氧化生成Na2O2,失去2nA个电子
参考答案:A
本题解析:A项,8 g O2中的电子数为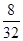 ×16×nA=4nA;B项,NH3·H2O为弱电解质,不完全电离,1 L 0.1 mol·L-1氨水中NH4+数小于0.1nA;C项,盐酸为混合物,HCl完全电离,没有HCl分子,且标准状况下盐酸为液体;D项,1 mol Na被完全氧化生成Na2O2,失去nA个电子。
×16×nA=4nA;B项,NH3·H2O为弱电解质,不完全电离,1 L 0.1 mol·L-1氨水中NH4+数小于0.1nA;C项,盐酸为混合物,HCl完全电离,没有HCl分子,且标准状况下盐酸为液体;D项,1 mol Na被完全氧化生成Na2O2,失去nA个电子。
本题难度:一般
2、选择题 化学反应aM+bN====cW+dE,已知20 g M和10.5 g N恰好完全反应,生成16.5 g E,则M与W的摩尔质量比为(??? )
参考答案:C
本题解析:根据质量守恒:
aM+bN====cW+dE
20 g 10.5 g? 14 g? 16.5 g
即M与W的摩尔质量比为: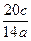 =10c∶7a。
=10c∶7a。
A.10a∶7c??????????? B.7a∶10c??????????? C.10c∶7a??????????? D.7c∶10a
本题难度:简单
3、选择题 在标准状况下,下列气体含有的分子数最多的是:???????????????????
A.36.5g HCl
B.22.4L O2
C.4g H2
D.0.5mol SO2
参考答案:D
本题解析:略
本题难度:一般
4、计算题 把10.2 g镁铝合金投入500 mL盐酸中,恰好完全反应,得到11.2 L H2(标准状况)。试计算:
(1)该盐酸的物质的量浓度;
(2)该合金中镁、铝的物质的量之比。
参考答案:(1)2mol/L???(2)1∶1
本题解析:
试题分析:(1)n(H2)=11.2 L÷22.4 L·mol-1 =0.5 mol
2HCl————H2
2 mol???? 22.4L
n(HCl)?? 11.2 L
解得n(HCl)=1mo
所以c(HCl)=1mol÷0.5L=2 mol/L
(2)设合金中Mg的物质的量为x,Al的物质的量为y
则24x + 27y=10.2 、x + 3/2y=0.5(mol)
解得x=0.2(mol)、y=0.2(mol)
则n(Mg)∶n(Al
本题难度:一般
5、选择题 设NA为阿伏加德罗常数的值。下列说法正确的是(????)
A.标准状况下,2.24 L戊烷所含分子数为0.1NA
B.0.3 mol NO2与水充分反应转移的电子数目为0.2NA
C.1mol Na2O2固体中所含的离子总数为4NA
D.60g SiO2晶体所含Si—O键的数目为2NA ,78 g苯含有C=C双键的数目为3NA
参考答案:B
本题解析:
试题分析:解答此类题目要注意(一)理清一套运算关系:n=N/NA=m/M=V/Vm=cV(aq)(二)注意审题细节1、微粒种类2、气体摩尔体积适用条件3、物质的组成和结构4、物质间的反应5、电离、水解。A、标准状况下,戊烷不是气体,2.24 L戊烷所含分子数大于0.1NA,错误;B、0.3 mol NO2与水充分反应转移的电子数目为0.2NA,正确;C、根据过氧化钠的电子式判断,1mol Na2O2固体中所含的离子总数为3NA,错误;D、60g SiO2的物质的量为1mol,根据晶体结构判断所含S
本题难度:一般