微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气和水,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是 。

(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。
肼—空气燃料电池放电时:
负极的电极反应式是 ;
正极的电极反应式是 。
(3)下图是一个电化学过程示意图。
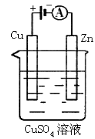
①锌片上发生的电极反应是 。
②假设使用肼—空气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼一空气燃料电池理论上消耗标准状况下的空气 L(假设空气中氧气体积含量为20%)
(4)传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液。该反应的离子方程式是 。
参考答案:(1)N2H4(1)+O2(g) =N2(g)+2H2O(1
本题解析:
本题难度:困难
2、填空题 (13分)
(1)25℃时,0.1 mol/L的HA溶液中c(H+)/c(OH-)=1010。请回答下列问题:
①HA是 (填“强电解质”或“弱电解质”)。
②在加水稀释HA溶液的过程中,随着水量的增加而增大的是 (填字母)。
A.c(H+)/c(HA) B.c(HA)/(A-) C.c(H+)与c(OH-)的乘积 D.c(OH-)
(2)已知:①CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.2kJ·mol-1
②CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=-247.4 kJ·mol-1
CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为 。
(3)下图是利用甲烷燃料电池电解50 mL 2 mol/L的氯化铜溶液的装置示意图:
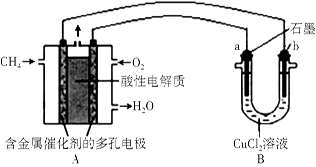
请回答:
① 甲烷燃料电池的负极反应式为 。
② 当线路中有0.6mol电子通过时,B中阳极产物的质量为 g。
参考答案:(1)①弱电解质 ②A、D;
(2)CH&#
本题解析:
试题分析:(1)25℃时,0.1 mol/L的HA溶液中c(H+)/c(OH-)=1010,c(H+)·c(OH-)=101-14,则c (H+)=0.01mol/L<c(HA),所以①HA是弱电解质;②在溶液中存在电离平衡:HA H++A-,在加水稀释HA溶液的过程中,随着水量的增加c(H+)、c(HA)都减小,电离平衡正向移动,所以c(H+)减小的倍数小于c(HA)减小的倍数,因此c(H+)/c(HA)增大,选项A正确; c(HA)减小的倍数大于 c(A-)减小的倍数,因此c(HA)/(A-)减小,错误;在稀释的过程中,c(H+)减小,但是在水溶液中存在水的电离平衡,由于温度不变,所以c(H+)与c(OH-)的乘积不变,是个常数,选项C错误;由于在水中存在水的电离平衡,c(H+)·c(OH-)="Kw," c(H+)减小,而c(OH-)增大,故选项D正确;(1)①×1-②,整理可得CH4(g)+2H2O(g)=CO2(g)+4H2(g) △H=+659.8 kJ/ mol;(3)① 在甲烷燃料电池中通入燃料甲烷的电极为负极,因为是酸性电解质,所以在电池的负极反应式为CH4-8e-+2H2O=CO2+8H+;② 在B中首先发生反应:CuCl2
H++A-,在加水稀释HA溶液的过程中,随着水量的增加c(H+)、c(HA)都减小,电离平衡正向移动,所以c(H+)减小的倍数小于c(HA)减小的倍数,因此c(H+)/c(HA)增大,选项A正确; c(HA)减小的倍数大于 c(A-)减小的倍数,因此c(HA)/(A-)减小,错误;在稀释的过程中,c(H+)减小,但是在水溶液中存在水的电离平衡,由于温度不变,所以c(H+)与c(OH-)的乘积不变,是个常数,选项C错误;由于在水中存在水的电离平衡,c(H+)·c(OH-)="Kw," c(H+)减小,而c(OH-)增大,故选项D正确;(1)①×1-②,整理可得CH4(g)+2H2O(g)=CO2(g)+4H2(g) △H=+659.8 kJ/ mol;(3)① 在甲烷燃料电池中通入燃料甲烷的电极为负极,因为是酸性电解质,所以在电池的负极反应式为CH4-8e-+2H2O=CO2+8H+;② 在B中首先发生反应:CuCl2 Cu+ Cl2↑。n(CuCl2)= 0.050 L ×2 mol/L=0.1mol,当该物质电解完全时,电子转移0.2mol,在阳极产生氯气0.1mol,后来电解的是水,电解方程式是:2H2O
Cu+ Cl2↑。n(CuCl2)= 0.050 L ×2 mol/L=0.1mol,当该物质电解完全时,电子转移0.2mol,在阳极产生氯气0.1mol,后来电解的是水,电解方程式是:2H2O O2↑+ 2H2↑,由于在整个闭合回路中电子转移数目相等,当线路中有0.6mol电子通过时,电解水转移电子的物质的量是0.4mol,此时产生氧气的物质的量是0.1mol,所以在B中阳极产物的质量为0.1mol×71g/mol+0.1mol×32g/mol=10.3g。
O2↑+ 2H2↑,由于在整个闭合回路中电子转移数目相等,当线路中有0.6mol电子通过时,电解水转移电子的物质的量是0.4mol,此时产生氧气的物质的量是0.1mol,所以在B中阳极产物的质量为0.1mol×71g/mol+0.1mol×32g/mol=10.3g。
考点:考查电解质的强弱的判断、物质稀释过程中微粒的浓度的变化、热化学方程式的书写、原电池和电解池的反应原理及应用的知识。
本题难度:困难
3、选择题 氯碱工业中,与铁丝网连接的是电源的?????????????(???)
A.负极
B.正极
C.阴极
D.阳极
参考答案:A
本题解析:在氯碱工业中,发生反应的方程式为: =====
=====
本题难度:简单
4、选择题 如图是模拟工业电解饱和食盐水的装置图,下列叙述正确的是

A.a 为电源的正极
B.通电一段时间后,石墨电极附近溶液先变红
C.Fe电极的电极反应是4OH-- 4e-=2H2O+O2↑
D.电解饱和食盐水的总反应是:
参考答案:D
本题解析:Fe极做阴极,a是负极,H+发生还原反应,产生H2和NaOH;石墨做正极,Cl-发生氧化反应,产生Cl2;答案选D。
本题难度:一般
5、填空题 A、B、C是三个电解槽,阳极均是Pt电极。A槽是CuCl2做电解液,纯铜片做阴极;B和C两槽以AgNO3溶液做电解液,纯银丝做阴极。先将A和B槽并联,再与C槽串联进行电解。若B槽中银丝质量增加0.108?g,C槽银丝质量增加0.216?g,则A槽中铜片增加的质量为_________________。
参考答案:0.032g
本题解析:本题是将A、B并联之后再与C串联,根据物理学电流定律可知:IC=IA+IB,可推出各电解池得失的电量关系为:QC=QA+QB。设A槽中铜片增加的质量为x,故有: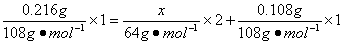
解得x="0.032" g
本题难度:一般