微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 可逆反应:2X+Y 2Z(气);ΔH<0,气体的平均摩尔质量M随温度变化如图所示,则下列说法正确的是(???)
2Z(气);ΔH<0,气体的平均摩尔质量M随温度变化如图所示,则下列说法正确的是(???)
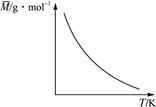
图2-58
A.X和Y可能都是固体
B.X和Y一定都是气体
C.若Y为固体,X一定是气体
D.X和Y不可能都是气体
参考答案:C
本题解析:若X和Y都是固体,则反应体系中只有一种气体Z,气体的摩尔质量不变;若X和Y都是气体,升温时,平衡左移,气体总质量不变,但总物质的量增加,混合气体的平均分子质量减小,但是若Y为固体时,X为气体,则为等体积反应,当升温时平衡左移,气体总质量减少,故平均摩尔质量减小,所以C项正确,B、D项不正确。
本题难度:一般
2、选择题 已知某可逆反应mA(g)+ nB(g) pC(g),在密闭容器中进行,下图表示在不同反应时间t、温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析,下列判断正确的是(???????)
pC(g),在密闭容器中进行,下图表示在不同反应时间t、温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析,下列判断正确的是(???????)
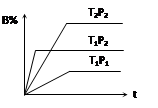
A.T1<T2、P1>P2、m+n>p,⊿H <0;
B.T1>T2、P1<P2、m+n>p,⊿H >0;
C.T1>T2、P1<P2、m+n<p,⊿H >0;
D.T1<T2、P1>P2、m+n<p,⊿H <0;
参考答案:C
本题解析:先看清横纵轴的意义:横轴表示时间,纵轴表示B的百分含量;
然后看线的走向:“T1P2、T2P2”线比较:在相同压强下,达平衡用时少的,温度高,即:T1 >T2;
“T1P1、T1P2”线比较:在相同温度下,达平衡用时少的,压强高,即:P2 >P1;
然后再看平行线部分:T1到T2(降温),B的百分含量增大,即平衡左移,说明逆向是放热的,则⊿H >0;
P1到P2(增压),B的百分含量增大,即平衡左移,说明逆向是气体体积减小的方向,则m+n<p;
本题难度:一般
3、选择题 对于可逆反应:2A(g)+B(g) 2C(g)?△H<0,下列各图正确的是
2C(g)?△H<0,下列各图正确的是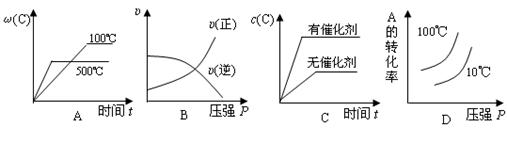
参考答案:A
本题解析:
试题分析:正反应是放热反应,温度越高,C的质量分数越小,A正确;增大压强,正、逆反应速率都加快,B错误;催化剂对平衡移动无影响,所以加催化剂与不加催化剂c(C)相同,C错误;增大压强,平衡向正反应方向移动,A的转化率增大,升高温度,平衡向逆反应方向移动,A的转化率减小,D错误。
点评:灵活运用勒沙特列原理。
本题难度:一般
4、选择题 下列说法正确的是???????????????????????????????????????
A.可逆反应的特征是正反应速率和逆反应速率相等
B.在其他条件不变时,使用催化剂只能改变反应速率而不能改变化学平衡状态
C.在其他条件不变时,升高温度可以使化学平衡向吸热方向移动
D.在其他条件不变时,增大压强一定会破坏气体反应平衡
参考答案:B、C
本题解析:选项A、D中隐含了“总是”,“一定”等绝对化的关键词,正确理解平衡有关的概念,本题正确选项为B、C。
本题难度:一般
5、简答题 (14分)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下图所示:
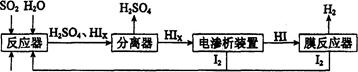
回答下列问题:
(1)在反应器中发生反应的化学方程式是______________。
(2)在膜反应器中发生反应:2HI(g) H2(g)十I2 △H>0。若在一定条件下密闭容器中加入l mol HI(g),? n(H2)随时间(t)的变化如图所示:
H2(g)十I2 △H>0。若在一定条件下密闭容器中加入l mol HI(g),? n(H2)随时间(t)的变化如图所示:

①该温度下,反应平衡常数K=_______,若升高温度,K值将_______
(填“增大”、“减小”或“不变?’)。
②用化学平衡原理解释使用膜反应器及时分离出H2的目的是___________________
(3)电渗析装置如下图所示:

①结合电极反应式解释阴极区HIx转化为HI的原理是______________________________
②该装置中发生的总反应的化学方程式是________________________
( 4)上述工艺流程中循环利用的物质是_________。
参考答案:(1)SO2+xI2+2H2O=H2SO4+2HIx;(2)
本题解析:
试题分析:(1)根据流程示意图可知:在反应器中发生反应的化学方程式是SO2+xI2+2H2O=H2SO4+2HIx;(2)①该温度下,反应平衡常数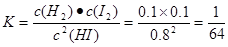 ;由于该反应的正反应是吸热反应,实验根据平衡移动原理,升高温度,化学平衡向吸热反应方向移动,实验化学平衡常数K值将增大;②使用膜反应器及时分离出H2,也就是减小了生成物的浓度,根据平衡移动原理,化学平衡向正反应方向移动,可以产生更多的生成物,从而提高了HI的分解率。(3)①由于阴极是与电源的负极连接的电极,有较多的负电荷,所以在阴极上发生反应:Ix-+(x-1)e-=xI-,根据同种电荷相互排斥,异种电荷相互吸引的原则,阳极区的H+通过交换膜进入阴极区,从而生成HI溶液;②根据电极反应式可知:该装置中发生的总反应的化学方程式是2HIx
;由于该反应的正反应是吸热反应,实验根据平衡移动原理,升高温度,化学平衡向吸热反应方向移动,实验化学平衡常数K值将增大;②使用膜反应器及时分离出H2,也就是减小了生成物的浓度,根据平衡移动原理,化学平衡向正反应方向移动,可以产生更多的生成物,从而提高了HI的分解率。(3)①由于阴极是与电源的负极连接的电极,有较多的负电荷,所以在阴极上发生反应:Ix-+(x-1)e-=xI-,根据同种电荷相互排斥,异种电荷相互吸引的原则,阳极区的H+通过交换膜进入阴极区,从而生成HI溶液;②根据电极反应式可知:该装置中发生的总反应的化学方程式是2HIx (x-1)I2+2HI;(4)在上述工艺流程中循环利用的物质是I2。
(x-1)I2+2HI;(4)在上述工艺流程中循环利用的物质是I2。
本题难度:一般