微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知化学反应N2+ O2=2NO的能量变化如图所示,判断下列叙述中正确的是(????)

A.该反应为放热反应
B.该反应每生成2 mol NO,吸收b kJ热量
C.该反应中反应物的总能量高于生成物的总能量
D.该反应吸收 热量时,参加反应的O2为0.5 mol
热量时,参加反应的O2为0.5 mol
参考答案:D
本题解析:略
本题难度:简单
2、选择题 下列说法正确的是?
[?????]
A. 化合反应一定是放热反应
B. 所有化学反应过程中,不仅有物质的变化,同时还伴随着能量的变化
C. 25℃.101时,CH4的燃烧热为-890.31g/mol
D. 因为弱电解质在水溶液里的电离都是吸热的,所以电化学反应都是吸热反应
参考答案:B
本题解析:
本题难度:简单
3、选择题 强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ·mol-1。醋酸溶液、浓硫酸、稀硝酸分别与0.1mol·L-1的NaOH溶液恰好完全反应放出的热量关系图如下。则下列描述正确的是(???)
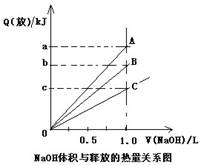
A.A是稀硝酸与NaOH溶液反应
B.B是醋酸溶液与NaOH溶液反应
C.b是5.73
D.C是浓硫酸与NaOH溶液反应
参考答案:C
本题解析:略
本题难度:简单
4、选择题 强酸和强碱的稀溶液的中和热可表示为:H+(aq)+OH-(aq)=H2O(1)???????△H = -57.3kJ/mol
已知:CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(1)??????????????△H ="-" Q1kJ/mol
1/2 H2SO4(aq) + NaOH(aq) ="=" 1/2Na2SO4(aq) +H2O(1)?????????????△H ="-" Q2kJ/mol
HNO3(aq)+KOH(aq)=KNO3(aq)+H2O(1)????????????????????????△H ="-" Q3kJ/mol
上述反应均为溶液中的反应,则Q1、Q2、Q3的绝对值大小的关系为(??? )
A.Q1=Q2=Q3
B.Q2>Q1>Q3
C.Q2>Q3>Q1
D.Q2=Q3>Q1
参考答案:D
本题解析:
试题分析:、25℃,101kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ/mol,所以Q2=Q3;因醋酸是弱酸,电离时需要吸热,所以反应热Q1大于-57.3k J?mol-1,故Q1、Q2、Q3的绝对值大小为:Q2=Q3>Q1
点评:本题考查中和热的理解,因为中和反应是放热反应,注意比较大小时要考虑符号问题。
本题难度:一般
5、选择题  已知充分燃烧a g乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是???(??)????????????????????????????????
已知充分燃烧a g乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是???(??)????????????????????????????????
A.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=-2b kJ ? mol-1
B.C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l);ΔH=2b kJ ? mol-1
C.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=-4b kJ ? mol-1
D.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=b kJ ? mol-1
参考答案:C
本题解析:
试题分析:由于在乙炔C2H2分子中含有2个C原子,所以若产生1mol二氧化碳气体和液态水,并放出热量b kJ,则燃烧的乙炔C2H2的物质的量是0.5mol。其燃烧热是2bKJ/mol.所以乙炔燃烧的热化学方程式是2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=-4b kJ / mol。选项是C。
本题难度:一般