微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 甲醇广泛用作燃料电池的燃料,可出天然气来合成,已知:
①2CH4(g)+O2(g)=2CO(g)+4H2(g)??△H=-71kJ/mol
②CO(g)+2H2(g)=CH3OH(l)??△H=-90.5kJ/mol
③CH4(g)+2O2(g)=CO2+2H2O(g)??△H=-890kJ/mol
下列说法不能得出的结论是
A.反应②在任何温度下均能自发进行
B.CO(g)+2H2(g)=CH3OH(g)△H>-90.5kJ/mol
C.甲醇的燃烧热为764kJ/mol
D.若CO的燃烧热为282.5kJ/mol,则H2的燃烧热为286kJ/mol
参考答案:A
本题解析:反应②属于熵减反应,故其在低温下可以自发。故A错误。
本题难度:一般
2、选择题 电子表所用的纽扣电池的两极材料为锌和氧化银,电解质溶液为KOH溶液,其电极反应式是:Zn+2OH――2e-=ZnO+H2O;Ag2O+H2O+2e-=2Ag+2OH-。总反应式为:Ag2O+Zn=2Ag+ZnO,下列说法正确的是(????)
A.Zn为正极,Ag2O为负极
B.Zn为负极,Ag2O为正极
C.原电池工作时,正极区溶液PH值减小
D.原电池工作时,负极区溶液PH值增大
参考答案:B
本题解析:从电极反应式可以看出:Zn失电子为负极,且该区消耗OH-溶液PH值减小;Ag2O得电子为正极,且该区产生OH-溶液PH值增大。
本题难度:简单
3、选择题 电化学降解NO3-的原理如图所示。下列说法中正确的是
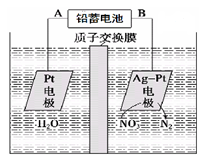
A.铅蓄电池的A极为负极,电极材料为Pb
B.铅蓄电池工作过程中每通过电路中2mol电子则消耗1molH2SO4
C.该电解池的阴极反应为2NO3- + 12H++ 10e- = N2↑ + 6H2O
D.若电解过程中转移5moL电子,则交换膜两侧电解液的质量变化差(Δm左—Δm右)为14.4g
参考答案:C
本题解析:
试题分析:A、根据题给装置知,右侧Ag—Pt电极上NO3-转化为N2,发生还原反应,为电解池的阴极,与铅蓄电池的负极相连,故铅蓄电池的B极为负极,电极材料为Pb,错误;B、铅蓄电池工作过程中的电池反应为:Pb + PbO2 + 4H+ + 2SO42-===2PbSO4+ 2H2O,每通过电路中2mol电子则消耗2molH2SO4,错误;C、该电解池的电解液呈酸性,阴极反应为2NO3- + 12H++ 10e- = N2↑ + 6H2O,正确;D、电解过程中阳极反应为4OH——4e—=2H2O+O2↑,若电解过程中转移5moL电子,则左侧生成1.25mol氧气,同时还有5mol氢离子进入右侧装置,Δm左=45g,右侧生成0.5mol氮气,Δm右=9g,则交换膜两侧电解液的质量变化差(Δm左—Δm右)为36g,错误。
考点:考查电解原理的应用。
本题难度:一般
4、选择题 钠氯化镍蓄电池是一种新型的电动汽车蓄电池,其正极MCl2中的M代表Ni、Fe、Ca、Cr、Mn、Cu等一系列金属,其中NiCl2的效果最好。而负极的活性物质是液态金属钠。正、负极活性物质被一种只允许Na+迁移的β-Al2O3固体电解质陶瓷管分隔,由于正极是固态多孔金属氧化物,所以还需要添加NaAlCl4熔盐在正极处作第二电解质,在正、负极之间传导钠离子。下列有关钠氯化镍蓄电池的说法错误的是
A.电池放电时的总反应为2Na+NiCl2===Ni+2NaCl
B.充电时阳极的电极反应为Na++e-===Na
C.放电时正极的电极反应为Ni2++2e-===Ni
D.该电池被称为绿色电池,最大原因是从废弃电池中可以方便地回收较纯的镍,其他产物对环境没有影响
参考答案:B
本题解析:
试题分析:该蓄电池放电时,负极反应为Na-e-===Na+,正极反应为Ni2++2e-===Ni,总反应式为2Na+NiCl2===Ni+2NaCl,故A、C正确;充电时,阴极电极反应为Na++e-===Na,故B错误。
点评:本题考查了蓄电池充放电时的电极反应,明确电池的正负极以及发生的反应是解题的关键。难度不大
本题难度:简单
5、填空题 能源问题是当前世界各国所面临的严重问题,同时全球气候变暖,生态环境问题日益突出,开发氢能、研制燃料电池、发展低碳经济是化学工作者的研究方向。
I.氢气通常用生产水煤气的方法制得。其中CO(g)+H2O(g)? ?CO2(g)+H2(g)
?CO2(g)+H2(g)
△H<0。在850℃时,平衡常数K=1。
(1)若降低温度到750℃时,达到平衡时K????1(填“大于”、“小于”或“等于”)
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0molCO、3molH2O、1.0molCO2
和x molH2,则:
①当x=5.0时,上述反应向???????(填“正反应”或“逆反应”)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是??????????。
③在850℃时,若设x=5.0和x=6.0,其它物质的投料不变,当上述反应达到平衡后,
测得H2的体积分数分别为a%、b%,则a??????b(填“大于”、“小于”或“等于”)
II.已知4.6g液态乙醇完全燃烧生成二氧化碳和液态水放出热量136kJ·mol液态水转
化为气体水吸收44kJ的热量。
(3)请写出乙醇燃烧生成气态水的热化学方程式
???????????????????????????????。
(4)将0.1mol乙醇在足量氧气中燃烧,得到的气体全部通入到100mL3mol/LNaOH溶液中,忽略HCO-3的电离,则所得溶液中c(CO2-3)??????c(HCO-3)(填“大于”、“小于”或“等于”,)原因是?????????????????????????????????????????????????(用文字叙述)。
参考答案:(1)大于(2分)
(2)①逆反应(2分)? ②x&l
本题解析:略
本题难度:一般