微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列反应中,属于氧化还原反应的是
A.CaCO3CaO+CO2↑
B.2Fe+3Cl2=2FeCl3
C.NH3+HCl=NH4Cl
D.Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
参考答案:B
本题解析:分析:氧化还原反应的特征是有化合价的升降,判断反应是否氧化还原反应,可判断元素的化合价是否发生变化.
解答:A.各元素的化合价都没有变化,不是氧化还原反应,故A不选;
B.Fe和Cl元素的化合价发生变化属于氧化还原反应,故B选;
C.各元素的化合价都没有变化,不是氧化还原反应,故C不选;
D.各元素的化合价都没有变化,不是氧化还原反应,故D不选.
故选B.
点评:本题考查氧化还原反应,题目难度不大,明确各元素的化合价是否发生变化是解答该题的关键.
本题难度:一般
2、填空题 (2014届甘肃省玉门市油田一中高三第三次摸底考试化学试卷)
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式。
(1)甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活。
已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(l) △H=" —1214" kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H=" —566" kJ/mol
则表示甲烷燃烧热的热化学方程式 。
(2) 将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。其负极电极反应式是: 。
(3)某同学利用甲烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是 (填序号)
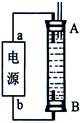
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H+ + 2e-= H2↑
(4)将不同量的CO(g)和H2O(g)分别通入体积
为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g)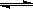 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组
| 温度/℃
| 起始量/mol
| 平衡量/mol
| 达到平衡所需时间/min
|
H2O
| CO
| CO2
|
1
| 650
| 2
| 4
| 1.6
| 5
|
2
| 900
| 1
| 2
| 0.4
| 3
|
3
| 900
| 1
| 2
| 0.4
| 1
①实验1中,以v (H2)表示的平均反应速率为 。
②实验3跟实验2相比,改变的条件可能是 (答一种情况即可)
参考答案:(1)CH4(g)+2O2(g) 本题解析: 本题解析:
(1)甲烷完全燃烧生成二氧化碳气体和液态水,所以甲烷燃烧热的热化学方程式中甲烷的物质的量是1mol,将①②相加除以2可得,答案是CH4(g)+2O2(g) CO2(g)+2H2O(l) △H1=—890KJ.mol-1 CO2(g)+2H2O(l) △H1=—890KJ.mol-1
(2)负极发生氧化反应,所以甲烷在负极发生氧化反应,结合电解质溶液,负极的电极反应式为CH4- 8e-+ 10 OH- CO32-+ 7H2O; CO32-+ 7H2O;
(3)A、电解过程中两极分别是H+和Fe放电生成氢气和亚铁离子,所以两极哪端都可以生成氢气,a不一定为正极,b不一定为负极,但a为正极,b为负极,效果较好,错误;B、在装置中铁一定作阳极,所以氯化钠溶液是电解质溶液,不影响阳极Fe放电生成亚铁离子,阴极H+放电生成氢气,正确;C、装置中铁一定作阳极,阴极可以是铁,也可以是其他惰性电极,错误;D、阴极H+放电生成氢气,正确,答案选BD。
(4)①实验1中,CO2的浓度增加0.8mol/L,所以氢气浓度也增加0.8mol/L,v (H2)= 0.8mol/L/5min=0.16mol/(L·min);
②实验3跟实验2相比,到达平衡时间缩短,说明反应速率加快,反应温度、各物质的物质的量均未变,所以可能是使用了催化剂或增大压强。
本题难度:一般
3、填空题 (12分)工业上一般可采用如下反应来合成甲醇:
CO(g)+2H2(g)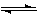 CH3OH(g)??ΔH=-a kJ·mol-1 CH3OH(g)??ΔH=-a kJ·mol-1
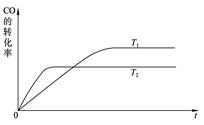
(1)上图是该反应在不同温度下CO的转化率随时间变化的曲线。
①a __0(填“>” “<” “=”)。
②下列说法正确的是_?????????_(填序号)。
a.1mol CO(g)和2mol H2(g)所具有的能量小于1mol CH3OH(g)所具有的能量
b.将1mol CO(g)和2mol H2(g)置于一密闭容器中充分反应后放出a KJ的热量
c.升高温度,平衡向逆反应移动,上述热化学方程式中的a值将减小
d.如将一定量CO(g)?和H2(g)置于某密闭容器中充分反应后放热aKJ,则此过程中有1molCO(g)被还原
(2)在一定条件下,科学家利用从烟道气中分离出CO2与太阳能电池电解水产生的H2合成甲醇,其过程如下图所示:
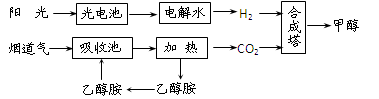
①该合成路线对于环境保护的价值在于_??????????????????????????????????_。
②15%~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,上述合成线路中用作CO2
吸收剂。用离子方程式表示乙醇胺水溶液呈弱碱性的原因:
????????????????????????????????????????????????????????????????????????????。
(3)甲醇燃料电池的工作原理如下左图所示。该电池工作时,c口通入的物质发生的电极
反应式为:_?????????????????????????????????????????????????????????????????_。

(4)以上述电池做电源,用上右图所示装置,在实验室中模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是(用相关的电极反应式和离子方程式表示):
_????????????????????????????????????????????????????????????????????????????。
参考答案:(1)① >(2分)?②d(2分)
(2)①有利
本题解析:考查外界条件对平衡的影响以及电化学的应用等。
(1)根据图像可知,温度为T2的曲线先达到平衡状态,所以T2大于T1。随着温度的升高,反应物的转化率是降低的,说明升高温度平衡向逆反应方向移动,所以正反应是放热反应,a大于0;反应放热,说明反应物的总能量大于生成物的总能量,a不正确。反应是可逆反应,1mol CO(g)和2mol H2(g)不可能生成1mol甲醇,所以放出的热量要小于akJ,b不正确。反应热与物质前面的化学计量数有关,与平衡的移动方向无关,c不正确。所以选项d是正确的。
(2)根据
本题难度:一般
4、填空题 已知:
2H2(气)+O2(气)=2H2O(气)+Q1???2H2(气)+O2(气)=2H2O(液)+Q2
2CO(气)+O2(气)=2CO2(气)+Q3
(1)关于Q1和Q2的关系正确的是______。
A.Q1>Q2
B.Q1<Q2
C.Q1=Q2
D.无法比较
你选择该答案的理由是______。
(2)CO和H2分别燃烧生成CO2和H2O(气),欲得到相同的热量,所需CO和H2的体积比是______。
参考答案:(1)B.液态水变成气态水需吸收热量或气态水变成液态水能放出
本题解析:(1)由于状态不同,反应热不同,所以写热化学方程式时,一定要注明各物质的聚集状态。否则判为错误(注:偶有通常状况为气体的物质不写其状态,即默认为气体);(2)设CO为nCOmol,H2为nH2mol,因气体的体积比等于物质的量之比(T,P一定时)。由题可知:
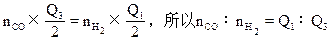
本题难度:一般
5、选择题 关于σ键和π键的比较,下列说法不正确的是( )
A.σ键是轴对称的,π键是镜像对称的
B.σ键是“头碰头”式重叠,π键是“肩并肩”式重叠
C.σ键不能断裂,π键容易断裂
D.H原子只能形成σ键,O原子可以形成σ键和π键
参考答案:C
本题解析:
试题分析:σ键也能断裂,选项C不正确,其余选项都是正确的,答案选C。
点评:该题是基础性试题的考查,试题基础性强,紧扣教材基础。该题的关键是明确σ键、π键的形成特点,然后结合题意灵活运用即可,难度不大。
本题难度:一般
|