微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列对于电解精炼铜与电镀的说法正确的是
A.电解精炼铜时是将电能转化为化学能,电路中每通过2mole-时,阳极就会溶解64克铜
B.电解精炼铜时阳极为精铜,阴极为粗铜,电解过程中电解质不需要更换
C.在铁质器皿上镀铝,电解质为熔融氧化铝,铁制器皿作阴极,阳极为铝棒
D.电镀过程中电镀液需要不断更换
参考答案:C
本题解析:A B.铜的精炼: 阳极Cu—2e—=Cu2+???阴极Cu2+十2e—="Cu" ;阳极为粗铜,阴极为精铜,电路中每通过2mole-时,阳极就会溶解多于64克粗铜;
D.电镀铜时,镀层金属(铜片)作阳极,待镀件(铁片)作阴极,用含有镀层金属离子的电解质(CuSO4)配成电镀液。阳极Cu—2e—=Cu2+???阴极Cu2+十2e—=Cu,电镀液浓度几乎保持不变,电镀过程中电镀液不需要更换。
本题难度:一般
2、选择题 下列说法正确的是
A.根据反应Cu+H2SO4 CuSO4+H2↑可推出Cu的还原性比H2的强
CuSO4+H2↑可推出Cu的还原性比H2的强
B.电解含Pb(NO3)2和Cu(NO3)2的溶液,阴极上阳离子得电子次顺依次是Cu2+、H+、Pb2+
C.含amolNa2S的溶液最多能吸收2.5amol的二氧化硫气体
D.因Cl2的氧化性强于I2的氧化性,所以置换反应I2+2NaClO3===2NaIO3+Cl2不能发生
参考答案:C
本题解析:
试题分析:A.根据反应Cu+H2SO4 CuSO4+H2↑不能推出Cu的还原性比H2的强,因为该反应不是自发进行的,电解是最强有力的氧化还原反应手段,A错误;B.电解含Pb(NO3)2和Cu(NO3)2的溶液,阳极上阳离子得电子次顺依次是Cu2+、H+、Pb2+,B错误;C.根据方程式2S2-+SO2+2H2O=3S+4OH-可知含amolNa2S的溶液消耗0.5amolSO2,同时产生2amol氢氧根,而氢氧根也能与SO2反应,即OH-+SO2=HSO3-,所以最多能吸收2.5amol的二氧化硫气体,C正确;D.氯酸钠的氧化性强于I2的氧化性,所以置换反应I2+2NaClO3===2NaIO3+Cl2能发生,D错误,答案选C。
CuSO4+H2↑不能推出Cu的还原性比H2的强,因为该反应不是自发进行的,电解是最强有力的氧化还原反应手段,A错误;B.电解含Pb(NO3)2和Cu(NO3)2的溶液,阳极上阳离子得电子次顺依次是Cu2+、H+、Pb2+,B错误;C.根据方程式2S2-+SO2+2H2O=3S+4OH-可知含amolNa2S的溶液消耗0.5amolSO2,同时产生2amol氢氧根,而氢氧根也能与SO2反应,即OH-+SO2=HSO3-,所以最多能吸收2.5amol的二氧化硫气体,C正确;D.氯酸钠的氧化性强于I2的氧化性,所以置换反应I2+2NaClO3===2NaIO3+Cl2能发生,D错误,答案选C。
考点:考查氧化还原反应、电解的有关应用与判断
本题难度:一般
3、选择题 观察下列几个装置示意图,有关叙述正确的是


A.装置①工业上可用于生产金属钠,电解过程中石墨电极产生金属,此法也可用于生产活泼金属镁、铝等
B.装置②中随着电解的进行左边电极会产生红色的铜,并且电流表示数不断变小
C.装置③中的离子交换膜只允许阳离子、阴离子和小分子水通过
D.装置④的待镀铁制品应与电源正极相连
参考答案:B
本题解析:
试题分析:A、装置①是电解装置,石墨是阳极,Fe是阴极,电解熔融氯化钠时,钠离子在Fe极析出,错误;B、装置②是电解池装置,左侧是阴极,铜离子放电生成红色单质铜,右侧是阳极,产生氯气,随反应的进行,氯化铜的浓度逐渐减小,单位时间内通过的电量逐渐减小,所以电流表的示数不断减小,正确;C、装置③是电解饱和食盐水的装置,由图可知该装置中的离子交换膜只允许阳离子、水分子通过,所以右侧得到浓度较高的氢氧化钠溶液,错误;D、装置④是电镀装置,镀层金属作阳极,待度制品作阴极,与电源的负极相连,错误,答案选B。
考点:考查电解反应原理的应用,电极产物的判断,电镀的应用
本题难度:一般
4、选择题 按图甲装置进行实验,若图乙中横坐标X表示通过电极的电子的物质的量。下列叙述正确的是
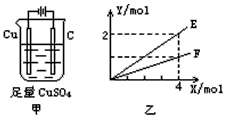 [???? ]
[???? ]
A.F表示反应生成Cu的物质的量
B.E表示反应消耗H2O的物质的量
C.E表示反应生成O2的物质的量
D.F表示反应生成H2SO4的物质的量
参考答案:B
本题解析:
本题难度:一般
5、选择题 用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入 0.1molCu(OH)2后恰好恢复到电解前的浓度和PH。则电解过程中转移的电子数为(????? )
A.0.1mol
B.0.2mol
C.0.3mol
D.0.4mol
参考答案:D
本题解析:
试题分析:根据电解池的工作原理,要想让电解后的电解质复原,则遵循的原则是:出什么加什么,加入?Cu(OH)2后溶液与电解前相同,则铜离子和氢氧根放电。
Cu(OH)2从组成上可看成CuO?H2O,溶液中加入0.1 mol Cu(OH)2后,溶液恰好恢复到电解前的浓度和pH,这说明电解生成了0.1 mol 氧化铜,并消耗0.1 mol H2O。由电解的总反应式可知:
2H2O+2CuSO4 本题难度:一般
本题难度:一般