微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用石墨作电极,电解1 mol/L下列物质的溶液,pH保持不变的是[???? ]
A.HCl
B.NaOH
C.Na2SO4
D.NaCl
参考答案:C
本题解析:
本题难度:一般
2、选择题 某同学为完成 2HCl+2Ag=2AgCl↓+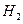 ↑反应,设计了下列四个实验如图所示。你认为可行的是??????????(???)
↑反应,设计了下列四个实验如图所示。你认为可行的是??????????(???)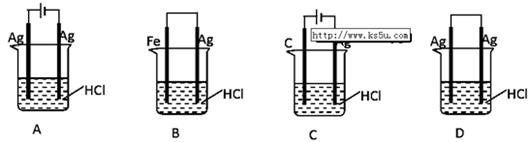
参考答案:A
本题解析:略
本题难度:简单
3、填空题 如下图,通电5 min后,电极5质量增加2.16 g,回答:

(1)电源:a是______极,b是______极;A池电极反应,电极1: ____________________;电极2: ______________。 C池电极反应,电极5: __________________;电极6: __________________。
(2)如果B池中共收集到224 mL气体(标准状况),且溶液体积为200 mL(设电解过程中溶液体积不变),则通电前溶液中Cu2+的物质的量浓度为____________。
参考答案:(1)负;正;2H++2e-→H2↑;2Cl--2e-→Cl
本题解析:
本题难度:一般
4、填空题 (每空2分,共10分)
研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:Fe2O3(s) + 3C(石墨) =" 2Fe(s)" + 3CO(g) △H 1 =" +489.0" kJ·mol-1
C(石墨) +CO2(g) = 2CO(g) △H 2 =" +172.5" kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为 。
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g) +3H2(g) CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H
①该反应的平衡常数表达式为K= 。
②取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应。反应经过相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图1所示,则该反应的ΔH 0(填“>”、“<”或“=”)。
③在两种不同温度下发生反应,测得CH3OH的物质的量随时间变化如图2所示,曲线I、Ⅱ对应的平衡常数大小关系为KⅠ KⅡ(填“>”、“<”或“=”)。
④用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,该电极反应的方程式为 。
参考答案:(1)Fe2O3(s)+3CO(g)=2Fe(s)+3CO2
本题解析:
试题分析:(1)根据盖斯定律,将一式将去二式乘以2可得所求方程式,所以CO还原氧化铁的反应热△H=△H 1 -3△H 2=-28.5kJ/mol,热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-28.5kJ/mol
(2)①根据平衡常数的定义可得,该反应的平衡常数表达式为K= c(CH3OH)×c(H2O)/c(CO2)×c(H2)3
②反应达到平衡时,甲醇的体积分数最大,再升高温度,甲醇的体积分数降低,说明升高温度,平衡逆向移动,所以正向是放热反应,△H<0;
③曲线II先出现拐点,说明II的温度高于I,因为温度升高,平衡逆向移动,所以甲醇的物质的量减少,温度升高,平衡常数减小,所以KⅠ> KⅠI;
④二氧化碳中C元素的化合价是+4价,甲烷中C元素的化合价是-4价,所以二氧化碳转化为甲烷得到8个电子,与来源:91考试网 91exam.org氢离子结合生成甲烷与水,电极反应式为CO2-8e-+8H+=CH4+2H2O。
考点:考查盖斯定律的应用,化学反应与能量关系的判断,化学平衡移动的判断,电极反应式的书写
本题难度:困难
5、选择题 如图乙所示是根据图甲的电解池进行电解时,某个量(纵坐标x)随时间变化的函数图象(各电解池都用石墨作电极,不考虑电解过程中溶液浓度变化对电极反应的影响),这个量x表示
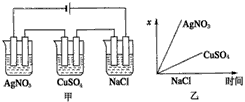 [???? ]
[???? ]
A.各电解池析出气体的体积
B.各电解池阳极质量的增加量
C.各电解池阴极质量的增加量
D.各电极上放电的离子总数
参考答案:C
本题解析:
本题难度:一般